气体的密度主要由以下什么因素决定:①气体分子的直径 ②气体物质的量的多少
③气体分子间的平均距离 ④气体分子的相对分子质量
| A.①② | B.①③ | C.②③ | D.③④ |
张老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量的KSCN的FeCl2溶液,溶液显红色,判断下列说法中正确的是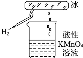
| A.该条件下生成的水分子化学性质比较活泼 |
| B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性 |
| C.该条件下H2燃烧生成了只具有氧化性的物质 |
| D.该条件下H2燃烧的产物中可能含有一定量的H2O2 |
铝硅合金具有熔点低、凝固时收缩率小等优点,适合铸造。现取试样10.0 mg,放在纯净氧气中完全燃烧,燃烧后的固体经称量发现比原来试样增重9.23 mg,由此计算硅铝合金中硅的质量分数为
| A.12.3% | B.15.4% | C.13.4% | D.17.0% |
将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
则下列说法正确的是
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的H2在标准状况下的体积为11.2 L
在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可看到灰黑色粉末,其中有些已变成棕褐色。将灰黑色粉末溶于盐酸,得浅绿色溶液。取上层清液滴入几滴氯水,再滴入KSCN溶液后溶液马上出现血红色。以下结论不正确的是
| A.该灰黑色粉末作抗氧化剂 |
| B.该灰黑色粉末不可食用 |
| C.小袋中原来装有铁粉 |
| D.小袋中原来装有Fe2O3 |
许多小溪流经硫矿和金属矿,由于含硫矿暴露在空气中或暴露在含氧的水中,这些小溪变成酸性,溪水中含有溶解的铁和硫酸盐,它们的浓度都很高。最常见的含硫矿是黄铁矿(FeS2),其中铁的化合价为+2;当富铁的溪水和其他水混合时,溶于水的铁以针铁矿[FeO(OH)]的形式沉淀出来,覆盖在小溪的底部,而水仍保持酸性。反应的离子方程式为4Fe2++O2+6H2O===4FeO(OH)↓+xH+,则该离子方程式中H+的化学计量数x为
| A.5 | B.6 | C.7 | D.8 |