分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是 ( )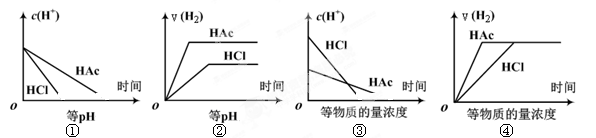
| A.①②③ | B.②④ | C. ①③ | D.①②③④ |
某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成Z,反应2min后,测得参加反应的X2为0.6mol/L,用Y2变化表示的反应速率v(Y2)= 0.1mol/(L⋅min),生成的c(Z) =" 0.4" mol/L,则该反应方程式为
A.3X2+Y2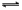 2X3Y 2X3Y |
B.2X2+Y2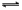 2X2Y 2X2Y |
C.X2+2 Y2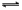 2XY2 2XY2 |
D.X2+3Y2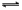 2XY3 2XY3 |
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断在100kPa压强下,下列结论正确的是
| A.石墨比金刚石稳定 |
| B.金刚石比石墨稳定 |
| C.1mol石墨比1mol金刚石的总能量高 |
| D.1mol石墨和1mol金刚石的总能量相等 |
互为同分异构体的物质不可能具有
| A.相同的式量 | B.相同的结构 | C.相同的通式 | D.相同的分子式 |
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色 ②苯分子中碳原子间的距离均相等 ③苯能在一定条件下跟H2加成生成环已烷 ④经实验测得邻二甲苯仅一种结构 ⑤苯在FeBr3存在条件下与液溴发生取代反应,但不因化学变化而使溴水褪色
| A.②③④⑤ | B.①②③④ | C.①②④⑤ | D.①③④⑤ |
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是
| A.3mol | B.4mol | C.5mol | D.6mol |