已知①CH3OH(g)+H20(g)=O2(g)+3H2(g) △H=+49.O kJ/mol
②CH3OH(g)+1/202(g)=CO2(g)+2H2(g) △H=-192.9 kJ/m01
下列说法正确的是 ( )
| A.CH30H转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
| C.根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g)△H>一192.9 kJ/mol |
| D.反应②的能量变化如图所示 |
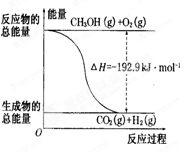
已知:CH3CH2CH2CH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2878
4CO2(g)+5H2O(l);DH =-2878  kJ
kJ
(CH3)2CHCH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2869 kJ
4CO2(g)+5H2O(l);DH =-2869 kJ
下列说法正确的是( )
| A.正丁烷分子储存的能量大于异丁烷分子 |
| B.正丁烷的稳定性大于异丁烷 |
| C.异丁烷转化为正丁烷的过程是一个放热过程 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li+MnO2==LiMnO2,下列说法正确的是()
| A.Li是正极,电极反应为Li-e- ="=" Li+ |
| B.Li是负极,电极反应为Li-e- ="=" Li+ |
| C.Li是负极,电极反应为MnO2 + e- ="=" MnO2- |
| D.Li是负极,电极反应为Li-2e- ="=" Li2+ |
一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是()
| A |
B |
C |
D |
|
| 正极 |
Zn |
Cu |
Zn |
Fe |
| 负极 |
Cu |
Zn |
Ag |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
已知299 K时,合成氨反应 N2(g)+ 3H2 (g)  2NH3 (g) △H =" -92.0" k
2NH3 (g) △H =" -92.0" k J/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)()
J/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)()
| A.一定大于92.0 kJ | B.一定等于92.0 kJ |
| C.一定小于92.0 kJ | D.不能确定 |
已知:H2(g)+F2(g)→2HF(g)△H=-270kJ·mol-1,下列说法正确的是()
| A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 |
| B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量 |