(1)下列是钠、碘、金刚石、锌、氟化钙晶体的晶胞图(未按顺序排序)。与冰的晶体结构相符的是________(请用相应的编号填写)。
(2)写出丙醛与新制氢氧化铜悬浊液反应的化学方程式:
____________________________________________________________________________________
(1)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:2NO2(g)⇌N2O4(g)当活塞迅速向里推时,气体的颜色先 ,后 (填“变深”“变浅”或“不变”前同);最终和最初相比,颜色 更深(填“最初”或“最终”下同),气体的平均相对分子质量 更大.
(2)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
①x= ,②B的转化率为 .
③温度降低,K值增大,则正反应是 (填“放热”或“吸热”)反应.
④能判断该反应达到平衡状态的依据是 (填编号)
A、混合气体的密度不变
B、容器中的压强不再变化
C、生成D的反应速率是生成B的反应速率的2倍
D、单位时间内生成3molA,同时生成1molB
⑤在其他条件不变的情况下,将原容器体积扩大到4L,下列有关该体系的说法正确的是()(填编号)
A、B的浓度减少
B、正反应速率加快,逆反应速率也加快
C、C的物质的量增加
D、重新平衡时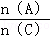 增大.
增大.
今有①CH3COOH、②HCl、③H2SO4三种溶液,请用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列的是 .
(2)当它们的物质的量浓度相同时,其pH由大到小排列的是 .
(3)中和等量的烧碱溶液,需同浓度的三种酸溶液的体积大小关系为 .
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,所需烧碱溶液的体积由大到小关系为 .
在氢氟酸溶液中,存在如下电离平衡:HF H++F﹣
H++F﹣
(1)加入固体NaOH,电离平衡向 反应方向移动,c(H+) .
(2)加入固体NaF,电离平衡向 反应方向移动,c(H+) .
(3)升高温度,电离平衡向 反应方向移动,c(H+) .
食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42―等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下: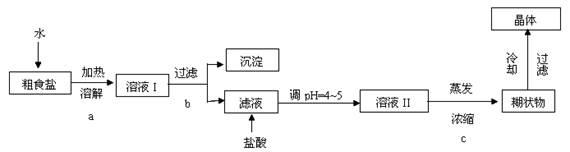
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42―离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH ii iii (填化学式)。
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i: ;
加入试剂iii: 。
(3)从NaCl溶液中得到NaCl晶体的操作步骤为 。
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如右:欲用上述浓盐酸配制实验所需浓度的稀盐酸480mL,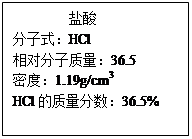
①配制需要的玻璃仪器有 (填仪器名称)
②需量取的浓盐酸的体积为: 。
已知反应:3NO2+H2O═2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为 .
(2)氧化剂与还原剂的物质的量之比为 .
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为 .
(4)用双线桥标出该反应中电子转移的方向和数目 .