已知碳、一氧化碳、晶体硅的燃烧热分别是△H =-393.5kJ/mol、△H ="-283" kJ/mol和△H ="-989" kJ/mol,则工业冶炼晶体硅反应2C(s)+SiO2(s)=" Si" (s)+2 CO(g) △H =
| A.+768 kJ/mol | B.-768 kJ/mol | C.+2342 kJ/mol | D.-2342 kJ/mol |
由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种以上元素,它们的分子质子总数均与氩原子相同。已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是()
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第二周期IV A族的元素,则丙一定是甲烷的同系物 |
| D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素 |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为2∶1时,则反应中Cu2S与被还原的HNO3的物质的量之比为()
| A.1∶6 | B.1∶7 | C.1∶8 | D.1∶9 |
下列各组离子在给定条件下,能大量共存的是()
| A.含有NO3–的水溶液中:NH4+、Fe2+、SO 42– 、H+ |
| B.含有CO32–的澄清透明溶液中:K+、C6H5O–、Cl–、Na+ |
| C.在pH=2的溶液中:ClO–、SO32–、Na+ 、K+ |
| D.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COO–、I– |
下列离子方程式正确的是()
| A.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3–+OH– = CaCO3↓+ H2O |
| B.NaHSO4溶液中滴加少量Ba(OH)2溶液 H++SO42-+Ba2++OH–= BaS04↓+H2O |
| C.FeBr2溶液中通人过量C12 2Fe2++6Br –+4C12 = Fe3++3Br2+8C1— |
| D.FeSO4溶液中加入H2O2溶液的反应: Fe2++2H2O2+4H+=Fe3++4H2O |
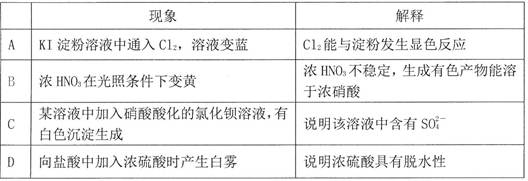
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是