关于化学计量的应用,下列说法正确的是:
| A.室温下,106g碳酸钠固体所含有的离子总的物质的量小于3mol |
| B.在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 |
| C.将物质的量浓度分别为1mol/L和2mol/L的硫酸等质量混合(假设体积可以加和),则混合后硫酸溶液的浓度为1.5mol/L |
| D.标况下,22.4L CH3Cl分子数约为6.02×1023 |
下列过程中△H大于零的是()
| A.乙醇燃烧 | B.酸碱中和反应 |
| C.碳酸钙分解得二氧化碳 | D.实验室制备氢气 |
能增加反应物分子中活化分子的百分数的是()
| A.升高温度 | B.降低温度 | C.增大压强 | D.增加浓度 |
下列溶液中加入少量NaOH固体导电能力变化不大的是()
| A.NH3·H2O | B.CH3COOH | C.盐酸 | D.H2O |
以下说法不正确的是()
| A.1mol乙醇可以与足量的乙酸作用,生成1mol 乙酸乙酯,能证明乙醇分子有一个H原子与其余的H原子不同 |
B.下列反应可证明受甲基的影响,甲苯比苯活泼,易被高锰酸钾氧化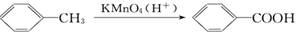 |
C.下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易 |
| D.苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键 |
断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断正确的是
虎茸草素异虎耳草素异佛手相内酯 6-甲氧基白芷素
①②③④
| A.①、②、③与④分别互为同分异构体 |
| B.①、③互为同系物 |
| C.①、②、③、④均能与氢氧化钠溶液反应 |
| D.等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |