(17分)某反应A(g)+B(g) C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,请用题干中的符号分别表示三种物质的浓度关系为 ,
平衡常数K=_ __。
(2)在300 K时,开始反应的A、B浓度均为0.1 mol/L,达到平衡时B的转化率为50%,则k1、k2之间的关系是__________________。
(3)升高温度,k1的变化是 ,k2的变化是_________(填“增大”、“减小”或“不变”);此时若k1/k2增大,则说明正反应是___________(填“吸”或“放”)热反应。
(4) CO2可与H2合成绿色燃料甲醇。300oC时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00 mol·L-1、c(H2)=1.60 mol·L-1时,分别选择催化剂Ⅰ、催化剂Ⅱ开始反应,t0时达到平衡状态M1、M2。若υ逆(M1)<υ正(M2)。且达M1时,CO2的转化率为20%,请画出两个状态的浓度商(Qc)-时间(t)的关系图像,并标明相关数据。
=
(5)实验室可利用甲醇、空气、铜(或氧化铜)制备甲醛。关于甲醇和甲醛的沸点和水溶性见下表:
| |
沸点 |
水溶性 |
| 甲醇 |
65℃ |
与水相溶 |
| 甲醛 |
-21℃ |
与水相溶 |
下图是某同学设计的实验装置,已知A处放入甲醇,C处收集到甲醛,若D处的气球在反应临近结束时使用,则B处应放入______(填化学式),请回答A、B、C三处采取控温的方式分别为A_____、B 、C ,(从下列选项中选择)
a.热水浴加热 b.冰水浴冷却 c.酒精灯加热 d.酒精喷灯灼烧 e.常温即可
实验临近结束时,挤压D处气球使空气进入装置,该操作的目的是____________________。
(1)等质量的O2和O3,它们的物质的量之比为,所含原子数之比为,所含电子数之比为,同温同压下的密度之比为。
(2)现有某气体,它由双原子分子构成,其摩尔质量为M g·mol-1,则ag该气体在标准状况下的体积约为_______________L。ag该气体溶于1L水中(不考虑与水反应,水的密度为1g/mL),其溶液中溶质的质量分数为__________。若最终溶液的密度为ρg/cm3,该溶液中溶质的物质的量浓度为______mol·L-1。
(1)将碎蛋壳(主要成分是CaCO3)浸泡在盐酸中会生成一种能使澄清石灰水变浑浊的无色气体。上述的两个反应的离子方程式为:①
②
(2)我们常在热水瓶中看到水垢,其主要成分是CaCO3和Mg(OH)2,要除去 水垢,常用的方法是向瓶中加入稀醋酸将其溶解,其反应的离子方程式为①
水垢,常用的方法是向瓶中加入稀醋酸将其溶解,其反应的离子方程式为①
②
(3)MgSO4溶液中滴加少量氨水,其反应的离子方程式为
(4)请将下列离子方程式改写为化学方程式:
① 2NH4+ + Ba2+ + 2OH- + SO42- = BaSO4↓+2NH3·H2O
② BaCO3 + 2H+ = Ba2++CO2↑+H2O
下列六种物质:
①烧碱;②锌;③碳酸钙;④二氧化碳;⑤BaSO4;⑥蔗糖。
请用序号填空。
(1)不溶于水,在高温下不易分解的电解质是;
(2)固态和熔融状态均能导电,但不是电解质的是;
(3)固态不导电,但在熔融状态或溶于水后均能导电的是;
(4)固体和熔融状态都不导电,溶于水后其溶液能导电的非电解质是。
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,甲是中学化学中常见的红棕色粉末状固体,它们之间的相互转化关系如图所示(部分产物及反应条件没有列出):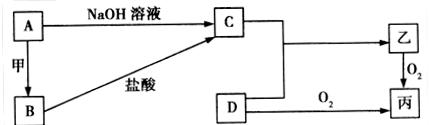
(1)写出框图中A转化为B的化学方程式:_______________________________________,该反应属于______________(填“吸热反应”或“放热反应”)。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物、有刺激性气味。已知16 g固体单质D完全燃烧转化成丙时,放出148.4 kJ的热量,则该反应的热化学方程式为:
_____________________________________________________________________________。
(3)若乙在水溶液中呈弱碱性,其盐可用作化肥,且C与D化合生成乙的反应是可逆反应。
①将等物质的量的C、D两种单质充入一体积恒定的密闭容器中,在适当催化剂和恒温条件下反应,下列说法中不正确的是____________(填字母)。
a.达到化学平衡时,2υ正(C) = 3υ逆(乙)
b.反应过程中,D单质的体积分数始终为50%
c.达到化学平衡时,混合气体的密度保持不变
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,乙的体积分数增大
②若在一个体积为10 L的密闭容器中,充入8 mol C单质和2 mol D单质,在一定温度下发生反应生成气体乙,经40 min后反应达到平衡,此时C的转化率为37.5%。从反应开始到达平衡的40 min内,用物质乙表示的化学反应速率为_________________________;达到平衡后,若向容器中按5∶1∶2的物质的量之比再次充入C、D、乙三种物质,则原平衡体系中C的转化率将_____________(填“增大”、“减小”或“不变”)。
某有机物蒸汽对H2的相对密度为43,请根据以下信息回答相应的问题:
(1)若该有机物A属于烃类,则分子式为_______________;写出其同分异构体中,一溴代物有3种物质的结构简式并命名:
____________________________________________________________________________。
(2)若该有机物B分子中C、H、O的原子个数之比为2∶3∶1,B物在酸性条件下水解可生成碳原子数相同的两种有机物C和D,B通过加聚反应可制得有机高分子化合物M,M常用做木材的黏合剂,俗称“乳白胶”。
①B分子中不含氧的官能团的名称为_________________________;
②B的同分异构体中属于链状不饱和羧酸的有三种,它们的结构简式是:
_________________________、_______________________、_________________________;
③写出B在一定条件下加聚反应生成M的化学方程式:
_____________________________________________________________________________;
④通常羟基与双键碳原子直接相连时,易发生下列转化: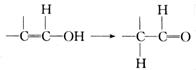
D能发生银镜反应,请写出D的结构简式:______________________________;
⑤已知:
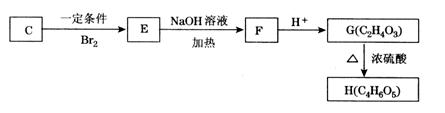
C可以发生如上图所示转化关系,写出以下化学方程式:
E→F:__________________________________________________________________;
G→H:__________________________________________________________________。