在平衡体系Ca(OH)2(s) 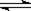 Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
| A.加入少量MgCl2固体 | B.加入少量HCl溶液 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
有机物A的结构简式为 :则A的同分异构体中带苯环的化合物共有
:则A的同分异构体中带苯环的化合物共有
| A.3种 | B.4种 | C.5种 | D.6种 |
乙酸乙酯与乙醛(CH3CHO)的混合物中氢元素的质量分数为1/11,则氧元素的质量分数为
| A.10/11 | B.4/25 | C.4/11 | D.4/5 |
常温下下列关系的表述中,正确的是
| A.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1 |
| B.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
| C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D.浓度均为0.1 mol/L的三种溶液:①Na2CO3溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
| A.该条件下此反应的化学平衡常数约为0.36 |
| B.A的平均反应速率为0.3mol/(L·min) |
| C.B的转化率为60% |
| D.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
如图,a、b、c、d均为石墨电极,下列说法正确的是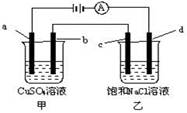
| A.甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 |
| B.甲烧杯中a电极发生氧化反应,电极反应式为:4OH―-4e-=O2↑+2H2O |
| C.电解一段时间后,b极质量增加,c极附近滴加酚酞溶液变红 |
| D.C是阳极,电子从d电极通过溶液流向c电极 |