在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
① 氧化剂是H3AsO3 ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol; ④ M为OH-; ⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w= |
| B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
C.溶液中c(OH-)= |
D.溶质的物质的量浓度 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是()
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
| A.①②③ | B.②③④ | C.③④ | D.①②③④ |
下列表示对应化学反应的离子方程式正确的是( )
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-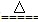 NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-===Ag++NO↑+H2O |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是()
| A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.三者对应的氧化物均为碱性氧化物 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
下列解释实验现象的反应方程式不正确的是()
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:4Na+O2==2Na2O |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-==Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2H2O===4NaOH+O2↑ |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: |
2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O