下列离子方程式正确的是 ( )
| A.向含0.2mol FeBr2的溶液中通入标准状况下的5.6L的Cl2 5Cl2+4Fe2++6Br-==4Fe3++3Br2+10Cl- |
| B.次氯酸钙溶液中通入过量的二氧化硫气体ClO-+H2O+SO2==HSO-3+HClO |
| C.向硫酸亚铁溶液中通入H2S气体Fe2++H2S==FeS↓+2H+ |
| D.Cl2通入石灰乳中制取漂白粉Cl2+2OH-==Cl-+H2O+ClO- |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)====Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-="===" Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>n,则该电解质可能是( )
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
A、B、C三个电解槽,如图4-14所示(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加0.128 g时,B中电极上银增加的质量为( )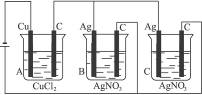
图4-14
A.0.054 g B.0.108 g C.0.216 g D.0.432 g
用惰性电极和串联电路电解下列物质的水溶液:①NaCl②NaNO3③CuCl2④AgNO3,在相同时间内生成气体的总体积(同温同压下测定),理论上从多到少的顺序是( )
| A.④①②③ | B.①②③④ | C.②①③④ | D.①②④③ |
电解CuSO4和NaCl的混合溶液,开始阴极和阳极上分别析出的物质是( )
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |