室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
8 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是 ( )
A.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=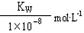
B.实验①反应后的溶液中:c(HA) +c(H+)= 1×10-6 mol·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)> c(K+)
D.实验②反应后的溶液中:c(H+)+c(K+)=c(A-)+c(OH-)
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
| A.2NaBr+Cl2=2NaCl+Br2 | B.C+CO2 2CO 2CO |
| C.2H2S+SO2=2H2O+3S↓ | D.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl |
下列说法正确的是
| A.绿色食品是不含任何化学物质的食品 |
| B.灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素 |
| C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 |
| D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等 |
向含有1mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,此时生成的Al(OH)3物质的量是
| A.1mol | B.1.33mol | C.0.67mol | D.0 mol |
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列性质与这些用途无关的是
| A.不易生诱 | B.导电性好 | C.密度小 | D.强度高 |
下列变化不可能通过一步实验直接完成的是
| A.Al→AlO2- | B.Al2O3→Al(OH)3 |
| C.Al(OH)3→Al2O3 | D.Al3+→AlO2- |