碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是( )
| A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间 |
| B.“侯氏制碱法”制得的碱是指NaHCO3 |
| C.可用盐酸鉴别Na2CO3和NaHCO3固体 |
| D.纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
实验室中,以下物质的贮存、处理方法,不正确的是()
| A.少量钠保存在煤油中 |
| B.氢氧化钠溶液贮存在带橡胶塞的玻璃试剂瓶中 |
| C.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
| D.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A.1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA |
| B.标况下,11.2L SO3所含的分子数目为0.5 NA |
| C.5.6克铁粉与硝酸反应失去的电子一定为0.3NA |
| D.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
下列说法正确的是( )
| A.根据是否有丁达尔效应,将分散系分为溶液、胶体和浊液 |
| B.SO2和SiO2都是酸性氧化物,都能与水反应生成酸 |
| C.漂白粉、水玻璃、氨水均为混合物 |
| D.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
下列有关化学用语表示正确的是( )
A.过氧化钠的电子式: |
B.次氯酸的结构式:H—Cl—O |
C.硫原子的结构示意图: |
D.NH4Cl的电子式: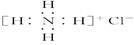 |
生活中的一些问题常涉及到化学知识,下列叙述正确的是()
| A.晶体硅具有半导体的性质,所以可以制作光导纤维 |
| B.燃煤中加入生石灰可以减少二氧化硫的排放 |
| C.明矾和漂白粉常用于自来水的处理,两者的作用原理相同 |
| D.氯化铁溶液可用于制作印刷电路板是因为其具有氧化性,与铜发生置换反应 |