将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-l的盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )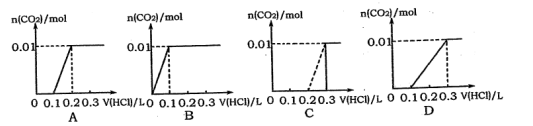
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)= Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是
| A.电池工作时,锌失去电子 ,锌是负极 |
| B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C.电池负极的电极反应式为:Zn-2e-+2OH—=Zn(OH)2 |
| D.电池工作时,电子由负极流向正极,溶液中OH—向正极移动,K+、H+向负极移动 |
下列装置或操作能达到实验目的的是
| A.分离乙酸和乙醇 | B.构成锌铜原电池 | C.制备乙酸乙酯 | D.制备蒸馏水 |
已知2SO2(g) + O2(g) 2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若升高温度,可以加快反应速率 |
| B.使用催化剂是为了加快反应速率 |
| C.在上述条件下,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是
| A.该反应是吸热反应 |
| B.断裂1molA-A键和 1molB-B键可放出xkJ能量 |
| C.断裂2molA-B键需要吸收ykJ能量 |
| D.2molAB的总能量高于1molA2和1molB2的总能量 |
25℃时,水的电离达到平衡:H2O H++OH;ΔH>0,下列叙述正确的是
H++OH;ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量稀硫酸,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |