下列图像分别表示有关反应的反应过程与能量变化的关系
据此判断下列说法中正确的是( )
| A.白磷比红磷稳定 |
| B.石墨转变为金刚石是吸热反应 |
| C.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2则△H1>△H2 |
| D.CO(g)+H2O(g)=CO2(g)+ H2 (g);△H1>0 |
下图为某兴趣小组制作的番茄电池,下列说法正确的是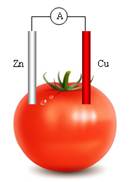
| A.电流由锌通过导线流向铜 |
| B.该装置将电能转化为化学能 |
| C.锌电极发生氧化反应 |
| D.铜电极的质量会不断减少 |
化学与生活、社会密切相关。下列做法正确的是
| A.城市生活垃圾应分类处理,废旧电池回收后集中掩埋,废弃的塑料焚烧处理 |
| B.若将原来燃烧液化石油气的灶具改成烧天然气,应增大空气进气量和减少天然气进入量 |
| C.鉴别棉纺线与羊毛线可用灼烧法鉴别 |
| D.糖尿病人可用氢氧化铜悬浊液检验其新鲜尿样中蔗糖含量的高低 |
下列关于卤族元素由上到下性质递变的叙述,正确的是
①元素的非金属性增强②单质的颜色加深③气态氢化物的稳定性增强
④单质的沸点升高⑤阴离子的还原性增强
| A.①②③ | B.②③④ |
| C.②④⑤ | D.①④⑤ |
下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是
| A.11和17 | B.1和8 |
| C.1和6 | D.6和12 |
金属冶炼中不会涉及到的反应类型是
| A.复分解反应 | B.置换反应 | C.分解反应 | D.氧化还原反应 |