下列关于反应热的说法正确的是
| A.当△H为“一”时,表示该反应为吸热反应 |
B.已知C(s)+ O2(g) O2(g) CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 |
| D.反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关 |
NA为阿伏伽德罗常数,下列叙述错误的是
| A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA |
| B.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 |
| C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA |
| D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
利用实验器材(规格和数量不限)能够完成相应实验的一项是
| 选项 |
实验器材(省略夹持装置) |
相应实验 |
| A |
三脚架、泥三角、坩埚、坩埚钳 |
煅烧石灰石制取生石灰 |
| B |
烧杯、玻璃棒、胶头滴管、100 mL容量瓶 |
用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
| C |
烧杯、玻璃棒、分液漏斗 |
用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D |
烧杯、酸式滴定管、碱式滴定管 |
用H2SO4标准液滴定未知浓度的NaOH溶液 |
下列说法不正确的是
| A.浓硝酸保存在玻璃塞的棕色试剂瓶中 |
| B.已经完成定容的500 mL 1.0 mol·L-1 的NaOH溶液,某同学不慎将容量瓶中溶液洒出,只能重新配制 |
| C.导管口点燃CO时需要验纯,H2加热还原CuO时也需要验纯 |
| D.物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
下列实验对应的结论或操作正确的是()
| A |
B |
C |
D |
|
| 装 置 |
 |
 |
 |
 |
| 结 论 |
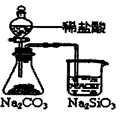
能证明非金属性 Cl >C > Si |
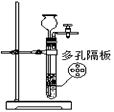
实验室制纯净干燥的乙炔 |
分离出苯酚与酒精溶液中的苯酚 |
实验室用大理石和稀盐酸制备二氧化碳 |
下列实验操作与预期的实验目的或结论均正确的是 ()
| 选项 |
实验操作 |
预期的实验目的或结论 |
| A |
对某白色固体进行焰色反应实验,火焰呈黄色 |
该物质为钠盐 |
| B |
SO2通入某红色溶液中,溶液褪色 |
该溶液为品红溶液 |
| C |
pH均为12的NaOH溶液、氨水分别用蒸馏水稀释 m倍、n倍后的pH相同 |
m<n |
| D |
蔗糖溶液中加入少量稀硫酸加热,然后加银氨溶液再加热 |
验证蔗糖是否发生水解 |