T℃时在2L的密闭容器中X(g)与Y (g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图l所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是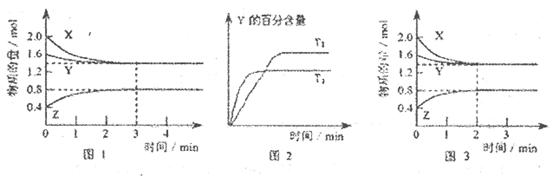
A.容器中发生的反应可表示为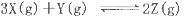 |
B.反应进行的前3 min内,用X表示的反应速率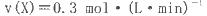 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
下列有关实验的叙述中,正确的是
| A.用氨水不能鉴别Al(NO3)3、AgNO3、KNO3三种溶液 |
B.如图所示的装置可用于干燥、收集并吸收多余的氨气 |
| C.少量的CO2通入苯酚钠溶液中生成NaHCO3,说明酸性:H2CO3>C6H5OH>HCO3— |
| D.淀粉和稀H2SO4混合加热后,再加新制的Cu(OH)2悬浊液加热至沸腾,无砖红色固 |
体生成,说明淀粉没有水解
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
| B.0.1mol·Lˉ1NaHC2O4溶液中:K+、Ba2+、OH-、Cl- |
| C.pH=7的溶液中:Fe3+、Na+、Cl-、NO3- |
| D.c(OH-)/c(H+)=1012的溶液中:K+、Ba2+、Cl-、Br- |
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.1molCH3+含电子数为10NA |
| B.质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA |
| C.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中反应,转移的电子数均为0.1 NA |
D.在反应S+2KNO3+3C K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA |
下列说法错误的是
| A.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| B.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| C.SO2、Cl2均具有消毒和漂白作用,其作用原理相同 |
| D.在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色褪去,可说明Na2CO3溶液 |
中存在水解平衡
下列离子方程式表达正确的是
A.Na2S的水解:S2ˉ+ 2H2O H2S +2OHˉ H2S +2OHˉ |
B.用铜电极电解CuSO4溶液:2Cu2++2H2O  2Cu+4H++O2↑ 2Cu+4H++O2↑ |
| C.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ =" 2Fe3+" + 2H2O |
| D.向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO |