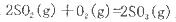 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的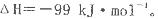 。请回答下问题;
。请回答下问题;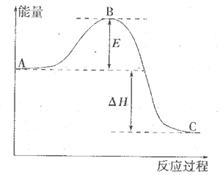
(1)E表示___________________;E的大小对该反应的反应热__________(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中△H___________(填“变大”、“变小”或“不变”),理由是________。
(3)已知单质硫的燃烧热为296 kJ·mol ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。
(4)在一定条件下向容积为2L的容器中通入4molSO2和3molO2,充分反应达平衡后,SO3的体积分数为1/3。若在相同的条件下向容积为2L的容器中通入amolSO2和,bmolSO3,和cmol,反应向逆反应方向进行且达到平衡时SO3的体积分数也为1/3。则c的取值范围为___________。
(本题共12分)Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。
完成下列填空:
28.若将Na2S2O3中的硫元素看作为+2价,下列反应中与Na2S2O3+H2SO4(稀) → Na2SO4+S↓+SO2↑+H2O属于同一类型的是_______(填序号)。
a.2H2S+SO2→ 3S↓+2H2O
b.3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
c.S+2H2SO4(浓)  3SO2↑+2H2O
3SO2↑+2H2O
d.4P+3NaOH+3H2O → 3NaH2PO2+PH3↑
29.棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____S2O32―+____Cl2+________ → ___SO42―+___Cl―+___H+
完成并配平该反应方程式;若反应中生成0.2 mol SO42―,则转移电子___________mol。
30.下图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是_______,④是______(填微粒符号)。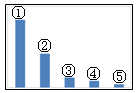
31.已知Na2S溶液显碱性,其主要原因是_________________(用离子方程式解释)。往装有Na2S溶液的烧杯中加入足量的ZnCl2溶液,产生白色的ZnS沉淀;再向烧杯中滴加CuCl2溶液,沉淀转变为黑色。请用溶解平衡原理解释上述现象______________________________________。
(本题共12分)合成尿素的反应为:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)+Q(Q>0)。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中气体的密度为4.2 g/L。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中气体的密度为4.2 g/L。
完成下列填空:
23.平均反应速率υ(NH3)=____________。
24.下列描述中能说明上述反应已达平衡的是_________(填序号)。
a.2υ正(NH3)=υ逆(H2O)
b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变
d.气体的压强不再发生变化
25.为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______(填序号)。
a.200℃b.800℃c.101 kPa d.24000 kPa
26.上述反应所涉及的4种元素中,原子半径从大到小的排列顺序为_________;原子核外有2个未成对电子的元素是________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________。
27.下列能用于判断氮、碳两种元素非金属性强弱的是________(填序号)。
a.气态氢化物沸点b.最高价氧化物对应水化物酸性强弱
c.HCN中,碳为+2价 d.单质晶体类型
(本题共12分)艾多昔芬可用于防治骨质疏松症,其合成路线如下(部分反应条件略去):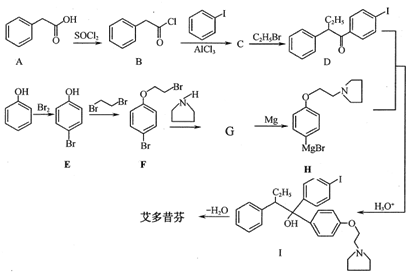
45.写出下列物质的结构简式:
C_________________________; 艾多昔芬____________________。
46.写出F→G的化学方程式____________________________________
47.写出同时满足下列条件的A的同分异构体的结构简式:___________________________。
①能发生银镜反应;②分子中有4种化学环境的氢原子;③能发生水解反应且产物之一遇FeCl3溶液显紫色。
48.请参照合成艾多昔芬的某些信息,完成以下合成路线流程图(在方框内填写有关物质的结构简式;反应条件略去):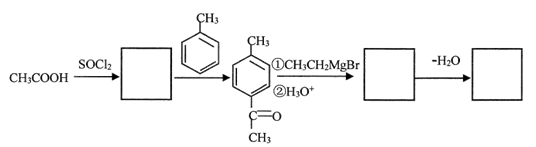
(本题共12分)南美洲干旱地区有智利硝石,是制取炸药的重要原料,其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物。NaNO3溶于水时溶液的温度降低。
36.以下操作可从智利硝石分离出NaNO3:溶解、______________________________。
37.用NaNO3和浓硫酸反应可以制取硝酸,反应的化学方程式为____________________;
热的硝酸会腐蚀橡胶,制取装置中应该用____________________________________代替胶管和胶塞。
38.分离出的NaIO3可通过以下反应制得I2: 4NaIO3+10NaHSO3→7Na2SO4+3H2SO4+2I2+2H2O
简述从反应后得到的混合物中分离出I2:的操作___________________________________。
NaHSO3过多或过少,I2的产率都会降低,当NaIO3与NaHSO3的物质的量之比为1:2.6时,I2的产率为________________。
39.智利硝石资源有限(曾引起过南太平洋战争),现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有(请结合课本知识回答)____________、制硝酸、__________等;写出工业制硝酸的化学方程式________________________、_______________________。
(本题共12分)
27.硫元素位于元素周期表第____列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释______________________________________。
28.S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有________个S-S键;
己知:H-S键键能:339 kJ/mol; H-Se键键能:314kJ/mol。以上键能数据能否比较S,Se非金属性的强弱_______(选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低_______。
29.在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此断NaHSO3溶液显_____性。
30.在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32- )=c(HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)_____________________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)= c(OH-)
c.c(Na+)+ c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
31.己知Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.