由Zn—Cu—H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。求:
(1)原电池生成氢气_______L(标准状况)。
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到_________kJ的热量。
(3)若起始时刻两电极质量相等,将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为__________g。
已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO4—+C2O42—+H+―→Mn2++CO2↑+H2O(未配平);
MnO2+C2O42—+H+―→Mn2++CO2↑+H2O(未配平)。
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20 g软锰矿样品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
(1)配平上述两个离子方程式:
___MnO+___C2O+___H+===___Mn2++___CO2↑+___H2O;
___MnO2+__C2O+___H+===___Mn2++___CO2↑+__H2O。
(2)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是__________(填数据所代表的意义)。
(3)若该数据的数值为250,求该软锰矿中二氧化锰的质量分数(写出计算过程)。
(1)恢复到室温后得到气体在标准状况下的体积
(2)恢复到室温后得到固体物质的质量(常温下水与Na2CO3会生成十水合碳酸钠)为g
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl中的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积。
在标准状况下,1.92g某气体所占体积为672mL,求该气体的相对分子质量。(要求写出计算过程)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信 息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测:
息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测: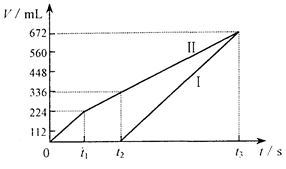
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。