下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )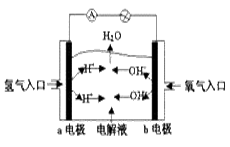
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-==2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置 |
下列离子方程式正确的是()
A.用铜为电极电解饱和食盐水:2Cl-+2H2O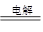 Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+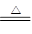 Fe3++3NO2↑+3H2O Fe3++3NO2↑+3H2O |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合: NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O |
| D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是()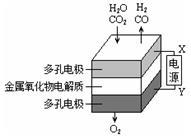
| A.X是电源的负极 |
| B.阴极的反应式是:H2O+2eˉ=H2+O2- |
| C.总反应可表示为:H2O+CO2=H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是2:1 |
某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO42-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色.根据以上实验现象,下列关于原溶液中离子成分的推测正确的是()
| A.一定有S2-、SO32-、Na+ | B.一定没有Ag+、Al3+ |
| C.可能只有Na+、S2-、CO32- | D.一定有Na+、S2-、NO3 |
用压强传感器探究生铁在pH=2和pH=4酸酸溶液中发生的装置及得到的图象如下:分析图象,以下结论错误的是()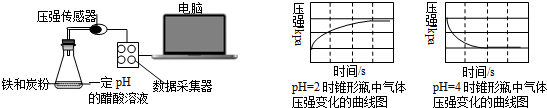
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe-2e-=Fe2+ |
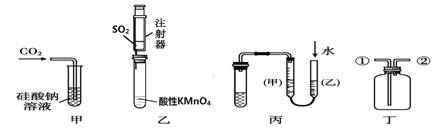
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是()