对于达到化学平衡状态的可逆反应:N2 + 3H2 2NH3 + Q,下列叙述中正确的
2NH3 + Q,下列叙述中正确的
| A.反应物和生成物的浓度相等 | B.反应物和生成物的浓度不再变化 |
| C.降低温度,平衡混合物中NH3的浓度减小 | D.增大压强,不利于氨的合成 |
已知①碳酸钙的分解CaCO3(s)===CaO(s)+CO2(g) ΔH1仅在高温下自发进行;②氯酸钾的分解 2KClO3(s)===2KCl(s)+3O2(g) ΔH2, 在任何温度下都自发进行,下面有几组焓变数据,其中可能正确的是
| A.ΔH1=-178.32 kJ·mol-1ΔH2=-78.3 kJ·mol-1 |
| B.ΔH1=+178.32 kJ·mol-1ΔH2=-78.3 kJ·mol-1 |
| C.ΔH1=-178.32 kJ·mol-1ΔH2=+78.3 kJ·mol-1 |
| D.ΔH1=+178.32 kJ·mol-1ΔH2=+78.3 kJ·mol-1 |
某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g) (HF)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法错误的是
(HF)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法错误的是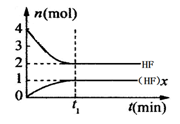
| A.x=2 |
| B.平衡时混合气体的平均摩尔质量是23.3g/mol |
| C.该温度下,反应的平衡常数为0.25 L·mol-1 |
| D.t1时刻,保持恒温恒容,再充入1mol HF(g),重新达到平衡时,c[(HF)x]/c(HF)增大 |
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)  2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是
2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是
| A.p1<p2,纵坐标指A的质量分数 |
| B.p1>p2,纵坐标指C的质量分数 |
| C.p1<p2,纵坐标指A的转化率 |
| D.p1<p2,纵坐标指混合气体的平均摩尔质量 |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是
| A.稀释后溶液中所有离子的浓度均减小 |
| B.稀释后溶液中c(OH-)小于稀释前的1/10 |
| C.稀释过程中氨水的电离平衡向左移动 |
D.稀释过程中溶液中 增大 增大 |