制备氰化钙的化学方程式为
CaCO3 + 2HCN = Ca(CN)2 + CO↑+ H2↑ + CO2↑,在反应中( )
| A.氢元素被氧化,碳元素被还原 |
| B.HCN既是氧化剂又是还原剂 |
| C.Ca(CN)2是氧化产物,H2是还原产物 |
| D.CO为氧化产物,H2为还原产物 |
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,
下列叙述中一定正确的是
| A.n>p |
| B.x点表示的正反应速率小于逆反应速率 |
| C.x点比y点时的反应速率慢 |
| D.若升高温度,该反应的平衡常数增大 |
对于可逆反应:2M(g)+N(g) 2P(g)△H<0,下列各图中正确的是
2P(g)△H<0,下列各图中正确的是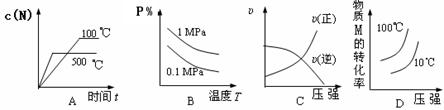
在一密闭容器中,反应mA(g) nB(g)+nC(g)达平衡后,保持温度不变, 将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则:
nB(g)+nC(g)达平衡后,保持温度不变, 将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则:
| A.平衡向正反应方向移动 | B.物质A的转化率增加 |
| C.物质C的质量分数增加 | D.m<2n |
在容积相同的两个密闭容器中,分别充入2 mol SO2和1 mol O2,使它们在相同的温度下发生反应2SO2(g)+O2(g) 2SO3(g),并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中SO2转化率为25%时,B容器中SO2的转化率应是
2SO3(g),并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中SO2转化率为25%时,B容器中SO2的转化率应是
| A.25% | B.>25% | C.<25% | D.12.5% |
CuI是一种白色难溶于水的固体,以石墨作阴极,铜为阳极组成电解池,含有酚酞和淀粉KI的溶液作电解液,电解开始一段时间,阴极区溶液变红,阳极区为无色,电解相当长时间后,阳极区才呈深蓝色,则电解开始阶段的电极反应为
| A.阳极:Cu-2e-===Cu2+阴极:Cu2++2e-===Cu |
| B.阳极:2Cu+2I--2e-===2CuI阴极:2H++2e-===H2↑ |
| C.阳极:2I--2e-===I2阴极:2H++2e-===H2↑ |
| D.阳极:4OH--4e-===2H2O+O2↑阴极:4H++4e-===2H2↑ |