常温下,稀释0.1 mol·L-1Na2CO3溶液,右图中的纵坐标可以表示
| A.CO32-水解的平衡常数 |
| B.溶液的pH |
| C.溶液中HCO3-离子数 |
| D.溶液中c(CO32-) |
热化学方程式中化学式前的化学计量数表示
| A.分子个数 | B.原子个数 | C.物质的质量 | D.物质的量 |
将下列四组溶液在烧杯中分别同时迅速混合,此时,硫代硫酸钠和盐酸缓慢地进行反应,则出现浑浊的先后顺序是
① 20℃ 10mL 5.4mol/L的Na2S2O3溶液和20mL 1.5mol/L盐酸
② 20℃ 10mL 4.0mol/L的Na2S2O3溶液和10mL 2.0mol/L盐酸
③ 30℃ 15mL 3.5mol/L的Na2S2O3溶液和10mL 2.5mol/L盐酸
④ 30℃ 20mL 3.0mol/L的Na2S2O3溶液和10mL 3.0mol/L盐酸
| A.③④②① | B.④③②① | C.①②③④ | D.④①③② |
在800℃时,下列可逆反应达到化学平衡状态:CO(g)+H2O(g)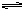 CO2(g)+H2(g),已知CO和H2O(g)的初始浓度为0.01mol·L-1时,H2平衡浓度为0.005mol·L-1。若此时再加入0.02mol·L-1的H2O(g),重新达到平衡时,H2平衡浓度为
CO2(g)+H2(g),已知CO和H2O(g)的初始浓度为0.01mol·L-1时,H2平衡浓度为0.005mol·L-1。若此时再加入0.02mol·L-1的H2O(g),重新达到平衡时,H2平衡浓度为
| A.0.0025 mol·L-1 | B.0.0075 mol·L-1 | C.0.010 mol·L-1 | D.0.015 mol·L-1 |
目前合成氨的技术原理为:
该反应的能量变化如图所示。在反应体系中加入催化剂,反应速率增大,△H的变化是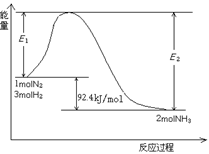
| A.增大 | B.减小 | C.不变 | D.以上都有可能 |
把0.6molX气体和0.4molY气体混和于2L容器中,使它们发生如下反应:
3X(g) + 2Y(g) 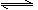 nZ(g) + 2W(g) 5分钟末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/(L· min),则上述反应中Z气体的计量数n的值是
nZ(g) + 2W(g) 5分钟末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/(L· min),则上述反应中Z气体的计量数n的值是
| A.1 | B.2 | C.3 | D.4 |