在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
A.平衡常数K = 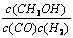 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.任意时刻,T2温度下的反应速率均大于T1温度下的速率 |
D.处于A点的反应体系从T1变到T2,达到平衡时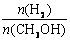 增大 增大 |
在100mL含等物质的量的HBr和H2SO3的溶液中通入0.01molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.0075mol/L | B.0.0018mol/L | C.0.075mol/L | D.0.08mol/L |
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A AlO2_ B Cu2+ C Al3+ D Mg2+
用光洁的铂丝蘸取无色溶液,在无色火焰上灼烧时观察到黄色火焰,则下列有关叙述正确的是
| A.只含有Na+ | B.一定含有Na+ | C.既含有Na+,又含有K+ | D.不可能含有K+ |
由锌、铁、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是
| A.锌 | B.铁 | C.铝 | D.镁 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余的气体排入空中,很快变为红棕色。对于混合气体成分的判断中正确的是
A、肯定有SO2和NO B、肯定有Cl2 O2和NO2
C 可能有Cl2和O2 D 肯定只有NO