下列各组物质的分类都正确的是(括号里的是类别) ( )
| A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) |
| B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质) |
| C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃) |
| D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯) |
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol ,向该溶液中加入足量铜粉,加热、充分反应后,所得溶液中c(Cu2+)的最大值为(反应前后溶液体积变化忽略不计)
,向该溶液中加入足量铜粉,加热、充分反应后,所得溶液中c(Cu2+)的最大值为(反应前后溶液体积变化忽略不计)
A.0.36 mol |
B.0.30 mol |
C.0.225 mol |
D.0.45 mol |
已知在pH值为4左右的环境中,Cu2+、Fe2+几乎不沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少最杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
| A.加入足量纯Cu粉,过滤 |
| B.向溶液中通入足量H2S,过滤 |
| C.向溶液中通入足量C12,再通NH3调节pH值为4左右,过滤 |
| D.向溶液中通入足量C12,再加纯净CuO粉末调节pH值为4左右,过滤 |
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过的电量。实际测量中,常用银电量计,如图所示。下列说法错误的是
| A.银电量计的工作原理类似电镀池,电量计中的铂坩埚上发生还原反应 |
| B.若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连 |
| C.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋,若没有收集网袋,测量结果会偏高 |
| D.称量电解前后铂坩埚的质量变化,得金属银的沉积量为10.8g,则电解过程中转移电子的物质的量为0.1 mol |
已知反应:2CO(g)+O2(g)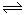 2CO2(g)△H<0。某温度下,将2 mol CO和1 mol O2置于10 L密闭容器中,反应达平衡后,CO的平衡转化率(
2CO2(g)△H<0。某温度下,将2 mol CO和1 mol O2置于10 L密闭容器中,反应达平衡后,CO的平衡转化率( )与体系总压强(p)的关系如图甲所示。则下列说法正确的是
)与体系总压强(p)的关系如图甲所示。则下列说法正确的是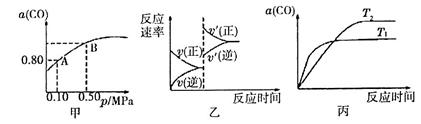
A.由图甲知,A点CO的平衡浓度为0.4 mol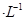 |
| B.由图甲知,B点CO、O2、CO2的平衡浓度之比为2:l:2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.若0.50 MPa时不同温度下CO转化率与温度关系如丙图,则T2>T1 |
下列叙述正确的是
| A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=1:1时,HCO3-部分转化为CaCO3 |
| B.CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 |
C.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时,铝元素以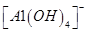 形式存在 形式存在 |
| D.Fe与稀硝酸反应,当n(Fe):n(HNO3) =1:1时,溶液中铁元素以Fe2+形式存在 |