卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为 ,请预测B的核磁共振氢谱上应该有 个峰(信号)。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。

实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是 。
②图2是为证明溴乙烷在NaOH乙醇溶液中发生的是消去
反应,实验中需要检验的产物是 ,
水的作用是 ,
实验现象是 。
(8分)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2―→O2.
(1)该反应中的还原剂是____________.
(2)该反应中,发生还原反应的过程是____________―→____________.
(3)写出该反应的化学方程式,并标出电子转移的方向和数目________________________________________________________________________.
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为____________.
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: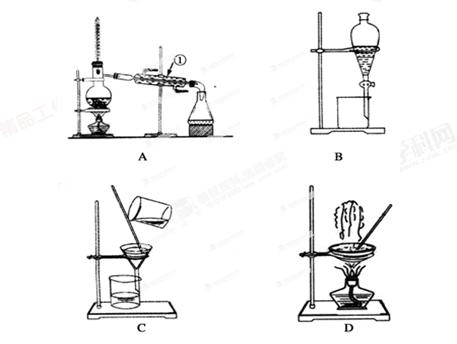
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中 的Cl-等杂质,选择装置________________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是_________________________________________。
【化学---选修模块:有机化学基础】
有机化合物A是一种农药生产的中间体,A在一定条件下可发生下列转化:
请回答下列 问题:
(1)A分子中含氧官能团的名称为。
(2)C不能发生反应的类型有 (填字母)。
a.取代 b.消去 c.加成 d.氧化 e.加聚
(3)F可能的结构简式为。
(4)反应①的化学方程式为。
(5)写出B到C的离子方程式。
(6)E在一定条件下反应能生成高分子化合物,其可能的结构简式为。
(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。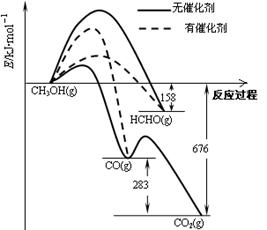
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2” 或“HCHO”)。2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H= 。
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性。用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
(2)已知:CO(g)+ 2H2(g) CH3OH(g)△H =" -a" kJ•mol-1。
CH3OH(g)△H =" -a" kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1,则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) |
5 |
10 |
15 |
20 |
25 |
30 |
| 压强比(P后/P前) |
0.98 |
0.90 |
0.80 |
0.70 |
0.70 |
0.70 |
则0~15 min,用H2表示的平均反应速率为 ,达到平衡时CO的转化率为 。
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染。吸收液吸收SO2的过程中,pH随n(SO3²-)∶n(HSO3-)变化关系如下表:
| n(SO3²-)∶n(HSO3-) |
91∶9 |
1∶1 |
1∶91 |
| pH |
8.2 |
7.2 |
6.2 |
根据上表判断NaHSO3溶液显 性。
② 在NaHSO3溶液中离子浓度关系正确的是 (填字母)。
a. c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
b. c(Na+)= 2c(SO32-)+ c(HSO3-)
c. c(H2SO3)+ c(H+)= c(SO32-)+ (OH-)
d. c( Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
有A、B、C、D四种物质,B的焰色反应为黄色。C是酸式盐,C加入硝酸酸化的Ba(NO3)2溶液中有白色沉淀生成。D和G相遇有大量白烟生成,D通入硝酸酸化的AgNO3溶液有白色沉淀生成。对A、B、C、D四种物质的水溶液进行下列实验,过程和现象如下图所示(图中部分产物未列出),请回答下列问题: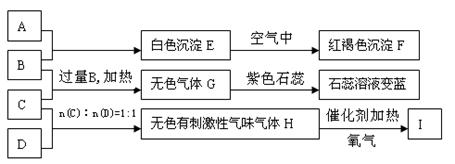
(1)B的电子式为____________________。
(2)H生成I的化学方程式为 。
(3)G在同主族同类物质中稳定性最强____,也是沸点最高的。(判断正误填“是”或“否”)
(4)A溶液中加入D,A溶液的颜色由浅绿色变黄,则A的化学式为__________ 。
(5)写出C与过量B反应(加热)的离子方程式 。
(6)C与D溶液恰好反应,假设生成气体全部逸出,所得溶液中离子浓度从大到小的顺序。
(7)25℃时pH=9的B溶液和pH=9的G溶液中,水的电离程度B___________G(填>,<或=)。