水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是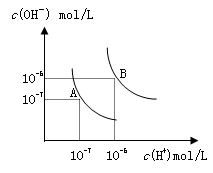
| A.纯水中25℃时的c(H+)比100℃时的c(H+)大 |
| B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3 |
| C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1 |
| D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1 |
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KClO3(混有KClO)。实
验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一定量Cl2,充分反应后,测得
溶液中n(Cl-)=11mol;将此溶液低温蒸干,得到的固体中KClO3的物质的量可能为
| A.2.20 | B.2.33 | C.2.00 | D.0.50 |
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物
质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分
含量与时间的关系如图-2所示。下列分析正确的是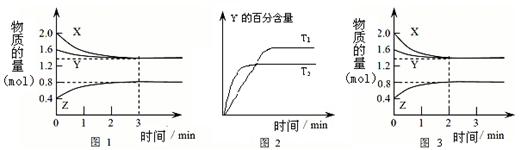
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g) 2Z(g) |
| B.0~3 min内,v(X)=0.2 mol•L-1•min-1 |
| C.其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 |
| D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强 |
给定条件下,加点物质能完全消耗于化学反应中的是
| A.用50mL 12mol/L的氯化氢水溶液与足量二氧化锰共热制取氯气 |
| B.向100mL 3 mol/L的硝酸中加入5.6g铁粉 |
| C.常温下,将1g铝片投入20mL 18.4 mol/L的硫酸中 |
| D.在5×107Pa、500℃和铁触媒条件下,1mol氮气和6mol氢气反应 |
已知2Al+2NaOH+2H2O→2NaAlO2+3H2。对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.6 mol H2,被还原的水分子数目为1.2NA |
| B.有2.7 g Al参加反应时,转移的电子数目为0.3NA |
| C.有6.72 L H2生成时,反应中转移的电子数目为0.6NA |
| D.溶液中每增加0.1mol AlO2-,Na+的数目就增加0.1NA |
运用电离常数判断可以发生的反应是
| 酸 |
电离常数(25oC) |
| 碳酸 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 |
Ki=2.4×10-9 |
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO