(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当 ,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 |
滴定前读数(mL) |
滴定后读数(mL) |
| 1 |
0.00 |
20.10 |
| 2 |
1.00 |
20.90 |
| 3 |
0.00 |
21.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
(1) 实验过程中,可能观察到的主要现象有:
① ;
② ;
③ ;
④ ;
(2) 用该装置做铜与浓硝酸反应的实验,最突出的优点是 。
(3) 若要验证最终得到的气体生成物,最简便的方法是 。
某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计如下实验方案,请回答有关问题:
(1)称取样品a g,称量时应该使用的仪器名称是_________。
(2)将样品溶于足量的稀盐酸,过滤,溶液中主要含有________,滤渣中含有_______。
(3)滤液中加入过量的NaOH溶液,过滤。所得滤渣的化学式为_________。
(4)往步骤(3)的滤液中通入足量的CO2气体,过滤。反应的离子方程式为_________。
(5)步骤(4)过滤所得的滤渣用蒸馏水洗涤3次,烘干后高温灼烧至质量不再减轻为止,称得其质量为b g,则原样品中铝的质量分数为_________(用a、b表示)。
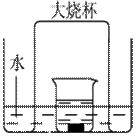
铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
图11-21
首先检查制氧装置的气密性,然后按图11-21连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于_________。能表示其原理的反应方程式为___________________________。
(2)仪器A的名称为_________,其中装的药品可以是_________,其作用是_________。
(3)由实验可知,该类铁生锈的条件为_________。决定铁生锈快慢的一个重要因素是_________。
某同学想通过比较两种最高价氧化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如下图的装置。请回答: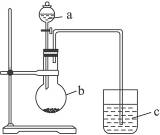
(1)仪器a的名称是__________,应盛放下列药品中的__________。
A.稀硫酸B.亚硫酸C.氢硫酸D.盐酸
(2)仪器b的名称是__________,应盛放下列药品中的__________。
A.碳酸钙B.硫酸钠C.氯化钠D.碳酸钠
(3)仪器c中应盛放的药品是_________,如果看到的现象是_________,证明b中反应产生了,即可说明__________比__________酸性强,非金属性__________比__________强,b中发生反应的离子方程式为____________________。
某同学设计如下实验方案,并记录了有关实验现象,如下表。请你帮助该同学整理完成实验报告。
(1)实验目的:______________________________________________________。
(2)实验用品:仪器__________________________________________________。
试剂_______________________________________________________________。
| 实验方案 |
实验现象 |
||||
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞溶液 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞的冷水反应 4.镁带与2 mol·L-1盐酸反应 5.铝条与2 mol·L-1盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 |
E.生成白色胶状沉淀,继而沉淀消失 |
(3)实验内容:
| 实验方案* |
实验现象* |
有关化学方程式 |
(4)实验结论:_______________________________________________________________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。