硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图10、图11分别是实验室模拟合成氨及氨催化氧化的装置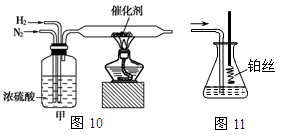
(1)氮气和氢气通过图10装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图11装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化 |
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为 。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量约为20%)。
某混合物是由NaCl、MgCl2、AlCl3三种物质组成的,Na、Mg、Al三种元素的质量比为23:12:9。求:(1)NaCl、MgCl2、AlCl3的物质的量的比?(2)氯原子为1mol时,混合物的质量?
配制250mL1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/L)体积为多少?取25 mL1.0mol/LH2SO4溶液与锌反应,在标准状况下产生多少升H2?求硫酸锌的物质的量?
在300 mL 2 mol/L H2SO4溶液中,溶质的质量是?此溶液中含 H+的物质的量是?H+的物质的量浓度是?
其中含有个SO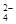 ? SO
? SO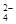 的物质的量浓度是?
的物质的量浓度是?
标况下CO与CO2的混合气体共22.4 L,其质量为36 g,求混合气体中CO与CO2的质量和体积各是多少?(要有步骤)
(每空2分,共8分).将4 g NaOH溶于_________g 水中,可使溶液中H2O与Na+的物质的量之比为20:1,此溶液中溶质的质量分数为;若测得该溶液的密度为1.1 g·cm-3,则该溶液体积为(精确到小数点后1位),溶液中c(Na+)为_________(精确到小数点后2位)。