下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 |
操 作 |
现 象 |
解释或结论 |
| A |
过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
| B |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
| C |
向某溶液中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 |
试纸变蓝 |
该溶液中存在NH4+ |
| D |
向紫色石蕊试液中通入SO2 |
溶液褪色 |
SO2有漂白性 |
下列实验操作中,用于分离食用油和氯化钠溶液的最佳方案是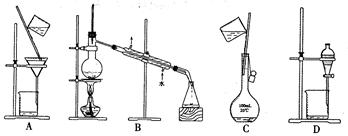
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(B)=0.3 mol·L-1·s-1
B.v(A)=0.5 mol·L-1·s-1
C.v(C)=0.6 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
下列说法中正确的是
| A.纯净物一定由分子构成 |
| B.混合物肯定由两种以上元素组成 |
| C.同种分子构成的物质一定是纯净物 |
| D.含有氧元素的化合物都是氧化物 |
等质量的CH4和NH3相比较,下列结论错误的是
| A.它们的分子个数比为17:16 |
| B.它们的原子个数比为17:16 |
| C.它们的氢原子个数比为17:12 |
| D.它们所含氢元素的质量比为17:12 |
实验室里需用950mL 0.1 mol/L的硫酸铜溶液时,下列操作正确的是
| A.称取15.2g硫酸铜固体,加入1000 mL水 |
| B.称取24g胆矾溶于水配成1000 mL溶液 |
| C.称取16 g硫酸铜固体,加入1000 mL水 |
| D.称取25 g胆矾溶于水配成1000 mL溶液 |