有人建议将氢元素排在元素周期表的第ⅦA族。下列事实能支持这一观点的是( )
①氢原子得到一个电子后最外层电子达到稳定结构 ②氢分子的结构式为H—H
③与碱金属元素形成离子化合物M+[∶H]- ④分子中原子间的化学键都属于非极性键
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
有一无色溶液,可能含有Fe3+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
| A.肯定有Al3+、Mg2+、NH4+、Cl- | B.肯定有Al3+、Mg2+、HCO3- |
| C.肯定有K+、HCO3-、MnO4- | D.肯定有Al3+、Mg2+、SO42- |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是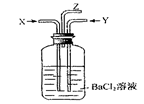
| A.洗气瓶中产生的沉淀是BaCO3 |
| B.在Z导管出来的气体中无CO2 |
| C.洗气瓶中产生的沉淀是BaSO3 |
| D.在Z导管口有红棕色气体出现 |
下列离子方程式正确的是
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.常温时56g铁片投入足量浓硫酸中生成NA个SO2分子 |
| B.12 g石墨和C60的混合物中质子总数一定为6NA个 |
| C.25℃,pH=12的Na2CO3溶液中含有CO32-的数目为0.01NA |
| D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
下列微粒在指定溶液中能够大量共存的一组是
| A.无色溶液中: Al3+、Cu2+、Cl-、SO42- |
| B.含有Na2CO3的溶液:Al3+、Ca2+、Cl-、NO3- |
| C.溶有大量Cl2的溶液:I-、SiO32-、K+、H+ |
| D.25℃时pH<7的溶液:K+、Na+、Fe3+、NO3- |