现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
请按要求回答下列问题:
(1)盛放烧碱液的试剂瓶不能用玻璃塞,是为了防止发生反应(用化学方程式表示),而使瓶塞与瓶口粘在一起;
(2)铝热反应在工业生产中的重要用途之一是;
(3)“ 硅材料”又被称为信息材料。其中广泛用于光导纤维的材料是(填化学式,下同);广泛用于制造集成电路的材料是;
醋柳酯是一种镇咳祛痰药。用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如右。回答下列问题:
(1)醋柳酯的分子式为。
(2)关于醋柳酯说法正确的是为()
| A.是高分子化合物 | B.可与氢气发生加成反应 |
| C.不能发生银镜反应 | D.能发生水解反应且只生成2种有机物 |
(3)醋柳酯可由下图所示路线合成
①中间产品C中混有反应物A和B,检验C中含有A的反应可以是(用化学反应方程式表示)
②写出C和足量NaOH溶液反应的化学方程
③A的同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式。
已知某有机物的结构简式为:
(1)该有机物中所含官能团的名称是____________、___________________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):
。
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
第三周期中的半导体材科 |
| B |
L层s电子数比p电子数少l |
| C |
地壳中含量最高的元素 |
| D |
第三周期主族元素中其第一电离能最大 |
| E |
第四周期中未成对电子数最多 |
(1)写出元素E基态原子的电子排布式:。
(2)C2单质分子中,含有个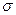 键和个
键和个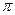 键,元素B的气态氢化的空间构型为。
键,元素B的气态氢化的空间构型为。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示):;
(4)D单质的熔点A单质的熔点(填“高于”或“低于”),其原因是:
。
氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存放着个σ键和个π键;
(3)N2分子中氮氮键的键长(填“大于”、“小于”或“等于”)
F2分子中氟氟键的键长;
(4)氮元素的氢化物——NH3是一种易液化的气体,该气体易液化的原因
是 。
(5)配合物[Cu(NH3)4]C12中含有4个配位键,若用2个N2H4代替其中2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]C12中含有配位键的个数为。