科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g) 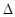 H="-92.4" kJ/mol,该反应的能量变化如图所示。
H="-92.4" kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的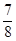 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol
又知:H2O(1)=H2O(g) 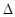 H="+44.0" kJ/mol
H="+44.0" kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g) 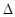 H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
有机物A的结构简式如右图:
⑴、A与过量NaOH完全反应时,A与参加反应的NaOH物质的量的比为.
⑵、A与新制的Cu(OH)2完全反应时,A与参加反应的Cu(OH)2的物质的量的比为
其中A与被还原的Cu(OH)2的物质的量的比为
⑶、A与过量的NaHCO3完全时,A与参加反应的NaHCO3的物质的量的比为。
某种高强度纤维由三种单体合成,结构为:
则这三种单体的结构简式为_____________、 _____________、。
将铜片投入盛有稀硫酸的试管中无反应。当加入少量硝酸钾晶体后,试管内产生一种无色气体,这种气体在试管口变成红棕色。这种无色气体是__________。写出有关的离子反应方程式.________________________________________________________
将Cu片放入0.1mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3; ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |