一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。则下列叙述中正确的是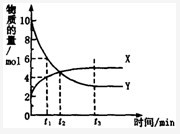
A .反应的化学方程式为2Y(g)=X(g)
B. t1时,Y的浓度是X浓度的1.5倍
C .t2时,可逆反应达到化学平衡状态
D.t3时,逆反应速率大于正反应速率
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-,下列叙述不正确的是
| A.H2通入负极区 | B.O2通入正极 |
| C.正极发生氧化反应 | D.负极反应为2H2 + 4OH- - 4e- = 4H2O |
可逆反应 2A (气) + 3B (气)  2C (气) + D(气),在四种不同条件下反应速率最快的是
2C (气) + D(气),在四种不同条件下反应速率最快的是
| A.VA = 0.5mol/(L·min) | B.VB = 0.6mol/(L·min) |
| C.VC = 0.35mol/(L·min) | D.VD = 0.4mol/(L·min) |
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 | C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
下列说法正确的是
| A.氯化氢溶于水能电离出H+和CI-,所以氯化氢是离子化合物 |
| B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 |
| C.氧气和臭氧是同分异构体 |
| D.有机物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体 |
一定温度下,可逆反应N2+3H2 2 NH3达到平衡的标志是
2 NH3达到平衡的标志是
| A.N2、H2、NH3浓度相等 |
| B.N2,H2,NH3分子数之比为1:3:2 |
| C.单位时间内生成nmolN2同时生成2nmolNH3 |
| D.单位时间内生成nmolN2同时生成3nmolH2 |