(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 |
H-H |
O=O |
H-O |
| 键能/kJ ·mol-1 |
436 |
498 |
X |
根据下图中能量变化图,回答下列问题: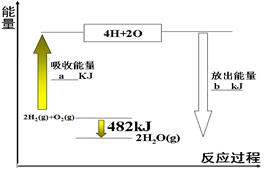
(1) 图中:a=___________。
(2) 表格中:X= 。
均衡的膳食结构可以保障身体健康。
(1)如果人体缺少易患夜盲症的维生素是。
(2)碳酸镁可治疗胃酸过多的原理是_____ ____(用离子方程表示)。
(3)油脂在人体内通过水解生成和甘油,再氧化分解,为人体提供能量。
(4)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“糖类”)不足引起的。下列食物中富含该物质的是(填字母)。
| A.菠菜 | B.花生油 | C.瘦肉 | D.西瓜 |
中共十八大报告提出:“大力推进生态文明建设”。
(1)向燃煤中加入石灰石作脱硫剂,可大大减少SO2的排放及酸雨的发生,用这种方法最终可将煤中的硫转化为(填化学式)。
(2)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌。液氯注入水中后,能杀死水中细菌,写出反应的化学方程式。
(3)对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,转化为CO2和(填化学式)。
阅读下列材料后回答问题。
一个体重60 kg健康的成年人,体内约含有4 g铁,这4 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+ Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
(2)“服用维生素C,可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应中作___________剂,具有___________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______________
(并用单线桥法标出该式中的电子转移方向和数目)。
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
| 溶液中检测出的溶质 |
|
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2CO3、NaCl |
| 第三次 |
KCl、K2CO3、Na2SO4、NaCl |
(1)三次检测结果中,第次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 |
实验操作 |
实验目的 |
反应的离子方程式 |
| 第一步 |
向溶液中滴加过量的硝酸 |
检验①的存在 |
② |
| 第二步 |
继续滴加过量的③溶液 |
检验SO42-的存在 |
④ |
| 第三步 |
过滤,再向滤液中滴加⑤溶液 |
检验⑥的存在 |
Ag++Cl- = AgCl↓ |
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
利用核磁共振技术可测定有机物分子的三维结构。在有机物分子中,不同位置的氢原子的核磁共振谱中给出的特征峰也不同,根据特征峰可以确定有机物分子中氢原子的种类和数目。例如,乙醚的结构简式为:CH3CH2OCH2CH3,其核磁共振氢谱中给出的特征峰有两个,如图所示:
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列物质中,其核磁共振氢谱给出的特征峰只有一个的是________。
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3COCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,A的结构简式为________,请预测B的核磁共振氢谱上有________个特征峰。
A的核磁共振氢谱
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子的结构简式的方法是___________________________________________________________。