实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数。
(1) 恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数为多少?
(2)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示,那么a点对应的溶液中,在单位体积中微粒数目最多的是 (填写化学符号)。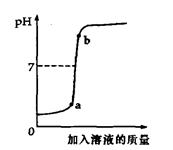
(3)将b点对应的溶液放在蒸发皿中慢慢地蒸干,所得的固体中除了NaCl外,还可能含有__ ____ _(写化学式)
某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%。李琳同学为了检验该产品,取l0g补钙品放入100g稀盐酸中,HCI与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应)。反应后剩余固体和液体的总质量比反应前减少了2.2g.求:
(1)补钙品中实际含钙的质量分数是多少?
(2)所用稀盐酸中溶质的质量分数是多少?
某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验。取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液。测得沉淀质量与所加入的氢氧化钠溶液的质量关系如下图:
根据所得数据计算:
(1)500g该废水中硫酸铜的质量。
(2)该废水中硫酸的溶质质量分数。
我国明确规定严禁酒后驾车,因为啤酒、红酒和白酒中都含有乙醇(C2H5OH),饮酒后乙醇可进入人体血液中,科学实验表明,当乙醇在人体血液中的含量超过80mg/100mL血时,便会影响人的驾车或操作机器的能力。据此回答下列问题,
(1)乙醇中含有种元素?
(2)计算乙醇的相对分子质量?(写出计算过程,下同)
(3)计算乙醇中各元素质量的质量比?
钢铁的生产和使用是人类文明和社会进步的一个重要的标志。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是
。
(2)校课外兴趣小组的同学们去潍坊某钢铁长生铁样品进行实验:将四份不同质量的生
铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4LH2的质量为2g)
| 实验序号 |
1 |
2 |
3 |
4 |
| 生铁样品的质量 / g |
2.88 |
5.76 |
9.24 |
10.28 |
| 生成H2的体积(标准状况下)/L |
1.12 |
2.24 |
3.36 |
m |
通过计算回答下列问题:
①上述表格中m的值为。
②根据表中数据计算稀硫酸中H2SO4的质量分数。
小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不和酸反应,也不溶于水),进行如下实验:称取10g赤铁矿样品,加入到烧杯中,再加入92.5g的稀硫酸,恰好完全反应。过滤得滤渣2.5g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?