已知酸性:H2SO4 >  >H2CO3>
>H2CO3>  > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将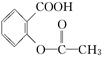 转变为
转变为 的最佳方法是( )
的最佳方法是( )
| A.与稀H2SO4共热后,加入足量的NaOH溶液 |
| B.与稀H2SO4共热后,加入足量的Na2CO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA |
| B.标准状况下,22.4L SO3中含有氧原子数为3NA |
| C.0.1mol/L稀硫酸中含SO42-离子个数为0.1NA |
| D.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
下列实验设计不能达到目的的是:
| A.苯与液溴在铁粉的催化作用下制备溴苯 | B.用酒精萃取碘水中的碘 |
| C.鉴别氢氧化铝胶体与碳酸钠溶液,用丁达尔效应 | D.检验Fe2+可用KSCN溶液和氯水 |
2009年5月18日,墨西哥流行病学与疾病控制中心负责人表示,检测到发生突变的甲型H1N1流感病毒。类似情况在美国和加拿大也被发现,这让学者非常担心,因为新病毒有可能具有更强的侵入性。下列说法正确的是
| A.病毒侵入机体内经T细胞摄取处理,暴露出病毒所特有的抗原特性 |
| B.效应T细胞能通过释放淋巴因子攻击被病毒入侵的细胞 |
| C.患儿痊愈后若再次感染该病毒,相应的记忆细胞会迅速产生抗体消灭病毒 |
| D.人体感染病毒后,需体液免疫和细胞免疫共同作用才可能彻底消除 |
取三粒质量和储藏时间相同的大豆种子,一粒在黑暗中萌发成豆芽甲,另两粒在光下萌发成幼苗乙、丙。测定甲、乙的鲜重和丙的干重,并与大豆种子比较,增加的重量分别为a、b、c,则a、b、c的主要增重因素分别为
| A.H2O;CO2;H2O和CO2 | B.CO2;H2O和CO2;H2O |
| C.CO2;H2O;H2O和CO2 | D.H2O;H2O和CO2;CO2 |
萝卜根形是由两对独立遗传的等位基因决定的。现用两个纯合的圆形块萝卜作亲本进行杂交, F1全为扁形块根。F1自交后代F2中扁形块根、圆形块根、长形块根的比例为9:6:1,现只保留其中的圆形块根,让其再自交一代,则F3中能稳定遗传的圆形块根所占的比例为
| A.5/6 | B.1/2 | C.3/8 | D.1/4 |