下表是某品牌食品包装袋上的说明
| 品名 |
肉松蛋卷 |
| 配料 |
小麦粉;②鸡蛋; ③食用植物油; ④白砂糖 ⑤肉松; ⑥食用盐; ⑦食用香料; ⑧β-胡萝卜素;⑨苯甲酸钠 |
| 生产日期 |
标于包装袋封口上 |
(1)配料中的着色剂是 (填序号)
(2)蛋白质是重要营养物质,处于生长发育期的青少年需要量很大。上述配料中,富含蛋白质的是
________。(填序号)
(3)食用植物油摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(4)该食品配料中还缺少的营养素是 (填名称);为均衡营养,可在食用该“肉松蛋卷”时,最好配以下列食品中的 (填标号)
A.牛肉 B.菠菜 C.马铃薯(土豆)
硒元素具有抗衰老、抑制癌细胞的功能,其化学性质与硫相似。硒的元素符号为Se,相对原子质量为79,对应的某种含氧酸的化学式为H2SeO3。
(1)这种酸应读作;
( 2)若将二氧化硫通入H2SeO3的溶液中,会有Se析出,写出该反应的化学方程式:
2)若将二氧化硫通入H2SeO3的溶液中,会有Se析出,写出该反应的化学方程式: ;
;
(3)又已知2HCl + H2SeO4 ="=" H2SeO3 + Cl2 + H2O,则H2SeO4、H2SeO3、H2SO3的氧化性由强到弱的顺序是。
为什么日常生活中能用热的纯碱溶液来洗涤沾有油脂的器皿:
下图是某市污水处理的工艺流程示意图: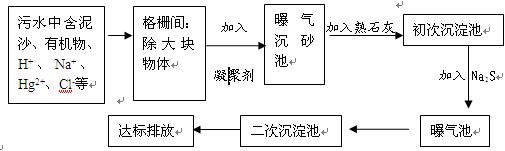
(1)常用的凝聚剂可以是(任填一种凝聚剂的名称)
(2)加入熟石灰的目的是,写出相关的化学方程式。
(3)加入Na2S的作用是。
要防止酸雨的产生,最直接的方法是阻止二氧化硫排放到空气中。回收二氧化硫的方法很多,常见的有石灰石及氨水法等,请大家根据原理写出反应的化学方程式。
(1)石灰石脱硫:
(2)氨水脱硫:
下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 |
浓缩菠萝汁 |
| 配 料 |
水.浓缩菠萝汁.蔗糖.柠檬酸.黄原胶.甜蜜素.维生素C,菠萝香精.柠檬黄.日落黄.山梨酸钾等 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装袋封口上 |
其中属于着色剂的有 ,属于调味剂的有 ,属于防腐剂的有 。