下列可证明甲烷分子是正四面体结构的是( )
| A.一氯甲烷没有同分异构体 | B.二氯甲烷没有同分异构体 |
| C.三氯甲烷没有同分异构体 | D.四氯甲烷没有同分异构体 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且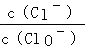 的值与温度高低有关.当n(KOH)="6a" mol时,下列有关说法错误的是
的值与温度高低有关.当n(KOH)="6a" mol时,下列有关说法错误的是
A.若某温度下,反应后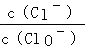 =11,则溶液中 =11,则溶液中 =0.5 =0.5 |
| B.参加反应的氯气的物质的量等于3a mol |
| C.改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
| D.改变温度,产物中KClO3的最大理论产量为2a mol |
只用下表提供的仪器、试剂,就能达到相应实验目的的是
| 选项 |
仪器 |
试剂 |
相应实验目的 |
| A |
托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 |
食盐,蒸馏水 |
配制500ml一定物质的量浓度的NaCl溶液 |
| B |
烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 |
AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸 |
除去AlCl3溶液中少量的MgCl2 |
| C |
铁架台(带铁圈、铁夹)、分液漏斗、洗气瓶、烧杯、圆底烧瓶、导管(若干)、石棉网 |
MnO2、稀盐酸、浓硫酸、饱和食盐水、氢氧化钠溶液 |
制备干燥纯净的Cl2 |
| D |
分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 |
稀盐酸,大理石,硅酸钠溶液 |
证明非金属性:Cl>C>Si |
一种瑞香素的衍生物的结构简式如图,下列有关该有机物性质的说法正确的是
| A.能与FeCl3溶液发生显色反应 |
| B.1mol该有机物最多可与3molH2加成 |
| C.1mol该有机物最多可与含5molNaOH的溶液反应 |
| D.1mol该有机物与足量NaHCO3溶液反应可放出3molCO2 |
碳纳米管是近年来材料科学研究的热点.为除去碳纳米管中的杂质——碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体.以下判断正确的是
| A.可以用浓盐酸调节K2Cr2O7溶液的酸性 |
| B.该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
| C.若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
| D.可以通过过滤的方法最终得到碳纳米管 |
下列有关说法正确的是
| A.明矾净水是因为Al(OH)3胶体能消毒 |
| B.氯化铝是电解质,电解熔融的氯化铝可制金属铝 |
| C.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| D.浓硝酸在光照下变黄,是因为硝酸不稳定,生成的有色气体能溶于浓硝酸 |