下列各组的电极材料和电解液,不能组成原电池的是( )
| A.铜片、石墨棒,硝酸银溶液 | B.铜片、石墨棒,稀硫酸 |
| C.锌片、铜片,稀盐酸 | D.铜片、银片,FeCl3溶液 |
下列对各个图象的描述正确的是()
A.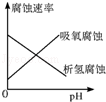 表示析氢腐蚀、吸氧腐蚀速率与金属周围溶液pH的关系) |
B.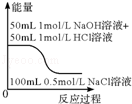 表示物质能量的大小关系 |
C.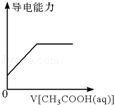 表示在氨水中加入同浓度的醋酸溶液时导电能力变化的情况 |
D.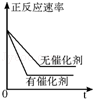 |
表示有无催化剂情况下正反应速率随时间变化的情况
以下对实验操作的说法正确的是()
| A.由于合金中金属的活泼性不同所以合金都易生锈 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.配制FeCl3溶液时,应将FeCl3溶解在适量的HCl中 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
下列叙述不正确的是()
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.氢氧燃料电池是一种将化学能转化为电能的装置 |
| C.可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D.塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
生活中常见的金属防护方法很多.下列对金属所采取的防护方法正确的是()
| A.铁制的健身器材刷油漆 | B.铁制品存放在潮湿的环境中 |
| C.在轮船船身上焊接一定数量的铜块 | D.地下钢铁管道连接锌块 |
在面盆、痰盂等铁制品表面烧制搪瓷的目的是()
| A.防止铁生锈且美观 | B.增大厚度防止磨损 |
| C.增大硬度防止撞坏 | D.美观和杀菌消毒作用 |