高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka] |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是( )
A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO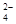
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中这四种酸都没有完全电离
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
青海昆仑玉被定为2008年北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2.下列有关说法不正确的是()
| A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O |
| B.透闪石中Mg元素的质量分数是Ca元素质量分数的1.5倍 |
| C.1 mol Ca2Mg5Si8O22(OH)2与足量的盐酸作用,至少需要14 mol HCl |
| D.透闪石是一种新型无机非金属材料,难溶于水 |
下列各组中的两种物 质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是()
质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是()
①碳酸钠溶液与盐酸②硫化氢气体与氯化铁溶液
③硫酸铝溶液与氨水④硝酸银溶液与氨水
⑤溴化亚铁溶液与氯水⑥碳酸氢钙溶液与澄清石灰水
| A.③⑤ | B.①③⑥ | C.②④ | D.②③⑥ |
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有()
| A.①②⑥ | B.全部 | C.①③④⑤ | D.②③⑥ |
下列有关金属及其化合物的说法正确的是()
| A.由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料 |
| B.往FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色 |
| C.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生 |
| D.铝粉和氧化镁粉末混合,高温能发生铝热反应 |
下列物质分类的正确组合是()
| 碱 |
酸 |
盐 |
酸性氧化物 |
|
| A |
纯碱 |
HNO3 |
胆矾 |
SO2 |
| B |
烧碱 |
H2SO4 |
NaCl |
CO |
| C |
苛性钠 |
CH3COOH |
石灰石 |
NO2 |
| D |
熟石灰 |
H2CO3 |
苏打 |
SiO2 |