已知常温下Ca(OH)2的KSP为5.6×10-6,在常温下将适量Ca(OH)2固体溶于100mL水中至刚好饱和,该过程中Ca2+和OH-浓度随时间变化关系如右图[饱和Ca(OH)2溶液中c(Ca2+)=1.118×10-2 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 CaCl2溶液,下列示意图中,能正确表示t1时刻后Ca2+和OH-浓度随时间变化关系的是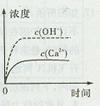
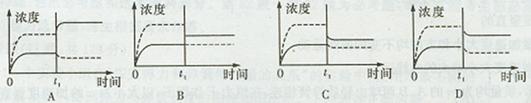
下列各图所示实验设计不能达到相应实验目的的是
| A.用图①比较KMnO4、Cl2、S的氧化性 |
| B.用图②所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| C.用图③所示实验从碘水中萃取碘 |
| D.用图④所示实验装置排空气法收集CO2气体 |
小强同学为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。将一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧。以下叙述错误的是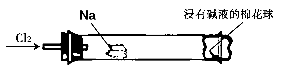
| A.反应生成的大量白色烟雾是氯化钠晶体 |
| B.钠着火燃烧产生苍白色火焰 |
| C.浸有NaOH溶液的棉球用于吸收生成的氯化钠,以免污染空气 |
| D.用湿润的淀粉碘化钾试纸可以检验氯气是否被完全吸收 |
下列叙述正确的是
| A.钠露置在空气中表面生成淡黄色的Na2O |
| B.将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| C.将CO2通入次氯酸钙溶液可生成次氯酸 |
| D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
关于硅及其化合物的叙述中,正确的是
| A.硅是良好的半导体材料,可以与NaOH 溶液和氢氟酸反应 |
B.二氧化硅与石灰石反应:SiO2+CaCO3 CaSiO3+CO↑ CaSiO3+CO↑ |
C.用焦炭还原二氧化硅生产硅:SiO2+2C Si+2CO2↑ Si+2CO2↑ |
| D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2 |
山东半岛蓝色经济区的建立使海洋经济将成为山东经济转型升级发展的重点。下列说法正确的是
| A.从海水中提取溴单质的过程中涉及氧化还原反应 |
| B.从海带中提取碘单质的过程中只涉及复分解反应 |
| C.从海水中提取镁单质的过程中要涉及置换反应 |
| D.从海水中提取氯化钠的过程中涉及化学反应 |