一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
| A.等于5 s | B.大于10 s | C.等于10 s | D.小于10 s |
分别处于元素周期表第2、3周期的主族元素A和B,它们离子的核外电子层相差两层。已知A处于第m族,B处于第n族,且A只有正化合价。则A、B两元素的原子序数分别为( )
A.m、n B.m-2、10-n C.m+2、n+10 D.m+8、n+10
A、B两主族元素属于同一周期,它们的原子能以共价键结合成化学式为AB2型分子,A、B元素在周期表中的族序数可能为()
A.ⅠA、ⅤA B.ⅢA、ⅦA C.ⅣA、ⅥA D.ⅠA、ⅦA
NA 表示阿伏加德罗常数的值,下列说法中正确的是
| A.常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
| B.0.1mol·L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol |
| C.7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA |
D.l.8 g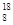 O2分子与1.8 g O2分子与1.8 g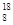 O3分子中含有的中子数不相同 O3分子中含有的中子数不相同 |
下列有关结构和性质的说法中,正确的是
| A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C |
| B.元素原子的最外层电子数越多,越容易得电子 |
| C.同周期主族元素的原子形成的简单离子电子层结构相同 |
| D.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
下列说法不正确的是
| A.某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| B.某微粒空间构型为V形,则中心原子一定有孤电子对 |
| C.某微粒空间构型为三角锥形,则该微粒一定是极性分子 |
| D.某微粒空间构型为正四面体,则键角一定是109°28’ |