瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是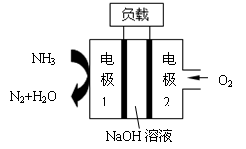
| A.电池工作时,Na+ 向负极移动 | B.通氨气的电极1作电池的正极 |
| C.电子由电极2经外电路流向电极1 | D.燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
同物质的量的SO2和SO3,下列说法正确的是()
| A.硫元素的质量之比为5︰4 | B.分子数之比为1︰1 |
| C.原子总数之比为4︰3 | D.质量之比为1︰1 |
下列状态的物质,既属于电解质又能导电的是()
A、酒精 B、氯化钾晶体 C、液态的氯气 D 熔融的氢氧化钠
实验室中配制250mL 0.10mo1·L-1NaOH溶液时,必须使用到的玻璃仪器是()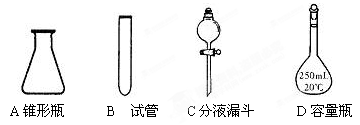
在10~18号元素中 ,能用表示核外电子排布的常见阳离子共有()
,能用表示核外电子排布的常见阳离子共有()
| A.1种 | B.2种 | C.3种 | D.4种 |
检验溶液中是否含有某种离子,下列操作方法正确的是()
| A.加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |
| B.加入BaCl2溶液,产生白色沉淀,证明有SO42- |
| C.加浓NaOH溶液后加热,产生使润湿的红色石蕊试纸变蓝色的气体,证明有NH4+ |
| D.无色溶液焰色反应呈黄色,证明试液一定不含K+ |