用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是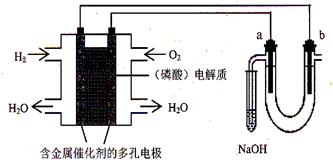
| A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH- |
| B.电解时,a 电极周围首先放电的是Cl— |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.2g H2 时,b极周围会产生2.24L H2 |
如下图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。如果刻度A和D都是4,则两处液面的读数是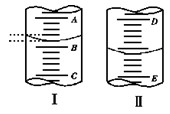
A.Ⅰ中是3.2 mL,Ⅱ中是5.40 mL
B.Ⅰ中是4.8 mL,Ⅱ中是3.40 mL
C.Ⅰ中是3.2 mL,Ⅱ中是4.60 mL
D.Ⅰ中是4.8 mL,Ⅱ中是4.60 mL
下列过程或现象与盐类水解无关的是
| A.铁在潮湿的环境下生锈 | B.纯碱溶液去油污 |
| C.加热氯化铁溶液颜色变深 | D.草木灰不宜与用作氮肥的铵盐使用 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 | B.水的离子积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 | D.水的离子积变大、pH变小、呈中性 |
在2 L的密闭容器中发生反应:2SO2 + O2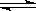 2SO3,如果2 min内SO2的量由12 mol
2SO3,如果2 min内SO2的量由12 mol
下降为4 mol,则下列说法正确的是
| A.用SO2的浓度变化表示的反应速率为4 mol/(L·min) |
| B.用O2的浓度变化表示的反应速率为2 mol/(L·min) |
| C.增大压强,正反应速率增大,逆反应速率减小 |
| D.升高温度,正反应速率和逆反应速率都增大 |
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
| A.CH3COONa固体 | B.NaOH溶液 | C.(NH4)2SO4粉末 | D.K2SO4固体 |