Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示: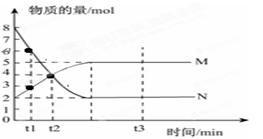
(1)此反应的化学方程式中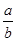 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
(3)平衡时,N的转化率为 。
(4)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化F.N的质量分数在混合气体中保持不变
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式 。
、
、
、
、
均为可溶于水的固体,组成它们的离子有
| 阳离子 |
|
| 阴离子 |
分别取它们的水溶液进行实验,结果如下:
①
溶液与
溶液反应生成白色沉淀,沉淀可溶于
溶液;
②
溶液与
溶液反应生成白色沉淀,沉淀可溶于
溶液;
③
溶液与
溶液反应生成白色沉淀,沉淀可溶于盐酸;
④
溶液与适量
溶液反应生成白色沉淀,加入过量
溶液,沉淀量减少,但不消失。
据此推断它们是
;
;
;
;
。
下图中A、B、C、D、E、F、G、H均为有机化合物。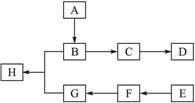
回答下列问题:
(1)有机化合物A的相对分子质量小于60,A能发生银镜反应,1 mol A在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是__________,由A生成B的反应类型是__________;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C生成D的化学方程式是______________________________;
(3)①芳香化合物E的分子式是C8H8Cl2。E的苯环上的一溴取代物只有一种,则E的所有可能的结构简式是____________________;
②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4)。1 mol G与足量的NaHCO3溶液反应可放出44.8 L CO2(标准状况),由此确定E的结构简式是________;
(4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是__________,该反应的反应类型是____________________。
烷基取代苯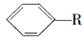 可以被高锰酸钾酸性溶液氧化生成
可以被高锰酸钾酸性溶液氧化生成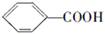 ,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到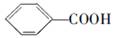 。现有分子式是C11H16的烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的烷基取代苯,已知它可以被氧化成为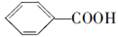 的异构体共有7种。其中3种是
的异构体共有7种。其中3种是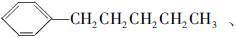
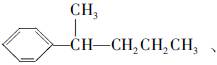
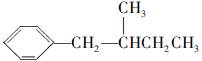
,请写出其他4种的结构简式:_____________,____________,__________,____________。
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是______________。
(2)A有2个不同的含氧官能团,其名称是___________。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是___________。
②A不能发生的反应是(填写序号字母)___________。
a.取代反应 b.消去反应
c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团并带有支链的同分异构体的结构简式___________、___________。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是__________________。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是______________。
如图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A____________________________________________,
B____________________________________________,
C____________________________________________,
D____________________________________________。
(2)在A、B、C、D各电极上析出生成物的物质的量之比为______________________。