某化学兴趣小组利用课余时间在实验室进行如下两个探究实验:
【探究一】利用废水回收铜,制备硫酸亚铁晶体。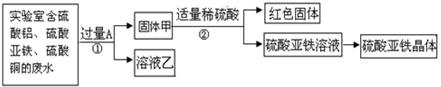
(1)红色固体是 (填化学式);溶液乙中溶质是 。
| A.硫酸铝 | B.硫酸亚铁 | C.硫酸铝和硫酸亚铁 | D.硫酸铜和硫酸铝 |
(2)写出步骤①的化学方程式: ;
【探究二】某硫酸亚铁晶体(FeSO4·xH2O)热分解研究并对x的测定
该兴趣小组同学称取ag硫酸亚铁晶体样品,先通干燥的氮气,然后按下图装置高温加热,使其完全分解,对所得产物进行探究。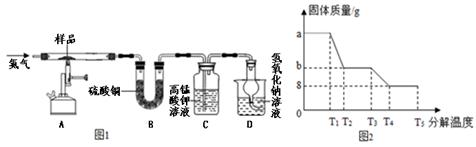
(3)装置B中硫酸铜粉末变蓝,说明产物中有 ,称量反应后装置B,增重12.6g
(4)装置C中 ,说明产物中还有SO2。
查阅资料得知二氧化硫气体能与高锰酸钾溶液发生如下反应:
5SO2 + 2KMnO4 + 2H2O X + 2MnSO4 + 2H2SO4 ,则X的化学式是 。
(5)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是 。
(6)D装置中球形干燥管的作用是 ,氢氧化钠溶液的作用是 。
(7)反应结束后还要不断的通入氮气直至冷却,其目的是 。
【数据处理】
兴趣小组同学利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图(图2)
①根据图2中有关数据,可计算出FeSO4•xH2O中的x值是 (要求写出计算过程)。
②从理论上分析得出硫酸亚铁分解还生成另一物质SO3,请写出T3—T4段发生反应的化学方程式 。
③上述试验中若将装置B和装置C进行调换,则测得FeSO4•xH2O中的x值会 (填“偏大”“偏小”或“不变”)
【2015年四川省眉山市】鸡蛋壳的主要成分是碳酸钙(其他成分不与水也不与盐酸反应)。为了测定鸡蛋壳碳酸钙的含量,进行如下实验:
请回答下列问题:
(1)鸡蛋含有的营养素主要为 。
(2)计算鸡蛋壳中碳酸钙的质量分数(写出简明的计算过程)。
【2015年福建省厦门市】胃酸主要成分是盐酸,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g。某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图所示抑酸剂,发生反应:Mg(OH)2+2HCl=MgCl2+2H2O。请计算并回答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是多少克?理论上能否使该患者胃液中盐酸溶质质量恢复到正常范围?(写出计算过程,结果精确到0.001)
【2015年湖北省武汉市】向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过滤,得到溶质质量分数为14.2%的无色溶液10g。请计算:
(1)所得溶液中溶质的质量是 ;
(2)实验前试管中氢氧化钠溶液的质量。
【2015年湖北省宜昌市】实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5g和 94.4g稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。求:
(1)生成二氧化碳的质量;(2)恰好完全反应后所得溶液中溶质的质量分数。
【2015贵州省安顺市】一定质量的氯化钡溶液和10g溶质质量分数为9.8%的稀硫酸恰好完全反应后,过滤得到28.47g滤液。请计算:
(1)生成硫酸钡沉淀的质量;
(2)氯化钡溶液的溶质质量分数。