某温度下,将0.2 molC(S)和0.3 mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g) CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
| A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol•L-1•min-1 |
| B.达平衡时压强变为原来的7/6 |
| C.此温度下该反应的平衡常数为0.0125 |
| D.若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
解释下列事实的离子方程式不正确的是()
A.Cu与浓H2SO4反应放出气体: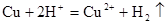 |
B.用大理石与稀盐酸制备CO2: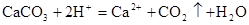 |
C.稀H2SO4与BaCl2溶液反应生成沉淀: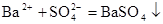 |
D.盛放NaOH溶液的试剂瓶不能用玻璃塞: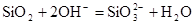 |
下列各组离子能大量共存的是()
A. 、 、 、 、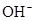 、 、 |
B.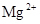 、 、 、 、 、 、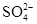 |
C.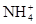 、 、 、 、 、 、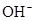 |
D. 、 、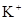 、 、 、 、 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.标准状况下,11.2 LO2和O3组成的混合气体含有原子数为NA |
| B.常温常压下,1.7 g NH3含有的电子数目为 NA |
| C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA |
| D.常温常压下,22.4 LCO2与足量Na2O2反应转移电子数为 NA |
下列物质中,不属于电解质的是()
| A.CO2 | B.NaCl | C.H2SO4 | D.KOH |
下列反应既属于离子反应,又属于氧化还原反应的是()
A.CaO+H2O= |
B.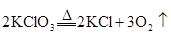 |
C.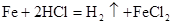 |
D.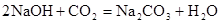 |