[化学--修3:物质结构与性质](15分)黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。回答下列问题:
(1)写出基态Fe2+的核外电子排布式________________________。K4[Fe(CN)6] 中Fe2+与CN-两种离子之间的作用力是________________________。
(2)CN-中碳原子的杂化方式为____________;1molCN-中含有π键的数目为________。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为________________________。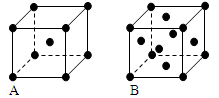
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为____________________________________________。
对于H-+H2O===H2+OH-说法正确的是
| A.该反应属于置换反应 |
| B.若该反应中有1 mol电子转移,则生成H2是22.4 L |
| C.水是氧化剂 |
| D.H2只是氧化产物 |
下列表示对应化学反应的离子方程式正确的是
| A.SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO42-+Fe2++4H+ |
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C.NO2通入水中:3NO2+H2O===2H++2NO3—+NO |
| D.过量的CO2通入NaAlO2溶液中:2AlO2—+CO2+3H2O===2Al(OH)3↓+CO32- |
下列各组离子在指定条件下能大量共存的是
①漂白粉的水溶液中:Fe2+、Cl—、Ca2+、Na+ ②滴加石蕊试液呈红色的溶液:K+、NH4+、Cl—、S2— ③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+ ④常温下pH =2的溶液中:NH4+、Na+、Cl—、Cu2+ ⑤无色溶液中:K+、CH3COO—、HCO3—、MnO4—
| A.②③ | B.①③ | C.③④ | D.①⑤ |
下列除去杂质的方法正确的是
| A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体 |
| B.除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 |
| C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
下列有机物的分离提纯方法正确的是
| A.除去乙酸乙酯中含有的乙酸杂质,可以加氢氧化钠溶液充分振荡后,分液。 |
| B.用重结晶的方法分离苯甲酸和氯化钠的混合物 |
| C.将工业酒精直接蒸馏可以获得无水酒精 |
| D.用酸性高锰酸钾溶液可以除掉甲烷中的乙烯杂质。 |