(14分)下表是元素周期表的一部分,回答有关问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
|
|
|
|
⑴ |
|
⑵ |
|
| 三 |
⑶ |
⑷ |
⑸ |
⑹ |
|
⑺ |
⑻ |
⑼ |
| 四 |
⑽ |
⑾ |
|
|
|
|
⑿ |
|
(1)写出下列元素符号:⑴ ,⑹ 。
(2)在这些元素中,最不活泼的元素的结构示意图是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为 ;碱性最强的与呈两性的发生反应的离子方程式为 。
(4)在⑵⑶⑻⑽这些元素简单离子中,离子半径由大到小的顺序是 (填离子符号)。
(5)元素⑻、⑾和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有 。
(6)用电子式表示由元素(8)和(10)形成化合物的过程: 。
I.肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。 已知在25℃、l0lkPA时,16gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量312kJ。
(1)该条件下,N2H4完全燃烧的热化学方程式为
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是(填字母)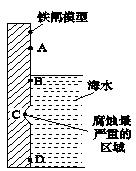
(3)下列各个装置中铁棒被腐蚀由难到易的顺序是______(填字母)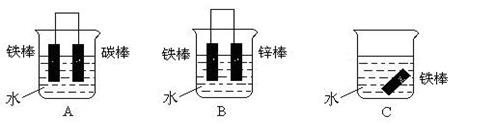
有A、B、C、D四种元素,它们均为短周期元素。已知A是非金属性最强的元素,且D与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3 。
(1)写出A元素的离子结构示意图
(2)C、D两种元素形成化合物的电子式
(3)写出B投入硫酸铜溶液中发生反应的化学方程式
(8分)698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) = 2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)容器的体积V=_____L
(2)反应达到最大限度的时间是__s,该时间内平均反应速率v(HI)=mol·L-1·s-1
(3)判断该反应达到平衡的依据是(填序号)
① (I2)=2
(I2)=2 (HI)
(HI)
②H2、I2、HI的浓度都不变
③容器内气体的压强保持不变
④容器内气体的密度保持不变
下图是某兴趣小组探究不同条件下化学能转变为电能的装置
(1)当电极A为Fe、电极B为Cu、电解质溶液为硫酸铜溶液时,正极的电极反应式为
(2)当电极A吸附CH4、电极B吸附O2,电解质溶液为氢氧化钠溶液时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请写出负极电极反应式
I.下列各组物质:
①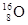 、
、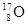 、
、 ②石墨和C60③水和冰
②石墨和C60③水和冰
④正戊烷和异戊烷⑤35Cl2、37Cl2
其中,
(1)属于同分异构体的是(填序号,下同)
(2)属于同素异形体的是
(3)属于同位素的是
II.下列6种固态物质:①P4②SiO2③NH4Cl ④NAF ⑤CO2(干冰)⑥金刚石,
回答下列问题:
(1)熔化时不需要破坏化学键的化合物是(填序号,下同)
(2)熔化时需要破坏共价键的单质是
(3)含有共价键的离子化合物是