短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是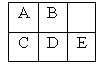
| A.原子半径:C<D<E |
| B.金属性:A>C |
| C.氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3 |
| D.最外层电子数:A>B |
下列叙述正确的是()
| A.聚丙烯的结构简式为: | |
| B.石英的化学式为:CaSiO3 | C.Ar原子的结构示意图为: |
| D.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构 |
最近媒体报道了一些化学物质,如:爆炸力极强的N5、结构类似白磷的P4、比黄金还贵的18O2、太空中的甲醇气团等。下列说法中,正确的是()
| A.18O2和16O2是两种不同的核素 |
| B.将ag铜丝灼烧成黑色后趁热插入甲醇中,铜丝变红,质量小于a g |
| C.P4为正四面体结构,每个分子中含有6个共价键,键角为109°28' |
| D.2N5= 5N2是化学变化 |
(2008·上海)下列关于化学学习和研究的说法错误的是()
| A.化学模型有助于解释一些化学现象 | B.质量守恒定律是大量实验事实的总结 |
| C.化学家提出的假设都能被实验证明 | D.化学基本原理的应用是有一定条件的 |
下列各组中的关系正确的是()
| A.同位素:O2和O3 | B.同分异构体:氨基乙酸和硝基乙烷 |
| C.同素异形体:K2O、K2O2、KO2 | D.同系物:分子式相差CnH2n+2的有机物 |
下列说法正确的是
| A.MgSO4晶体中只存在离子键 |
| B.含Ca2+、Mg2+的水都是硬水 |
| C.雾是气溶胶,在阳光下可观察到丁达尔效应 |
| D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2 |